Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Direkte Messung des pCO2 im Verdauungstrakt von Fischen
Zuverlässige Aufzeichnung des in vivo pCO2 in unterschiedlichen Teilen des Magen-Darm-Systems verschiedener Fischspezies mit einem faseroptischen pCO2 Mikrosensor
Chris M. Wood1,2, Junho Eom1,2, Ellen H. Jung1,2, and Fernando Martinez Ferreras3
1Department of Zoology, University of British Columbia, Vancouver, B. C., Kanada
2Bamfield Marine Sciences Centre, Bamfield, B. C., Kanada
3PreSens Precision Sensing GmbH, Regensburg, Deutschland
Unser Ziel war es den pCO2-Gehalt in den Magenflüssigkeiten und unterschiedlichen Teilen des Verdauungstraktes von sowohl nüchternen als auch gefütterten Fischen zu messen, die typischerweise zwischen 50 - 300 g wogen. Es war besonders wichtig, die Messungen vornehmen zu können ohne dabei den Verdauungstrakt aufzureißen, um ein Equilibrieren mit Umgebungsmedien zu verhindern. Konventionelle pCO2 Elektroden sind einfach zu groß um sie in den Verdauungstrakt einzuführen, ohne diesen schwer zu beschädigen. Die Elektroden sind auch nicht dafür ausgelegt in einer dickflüssigen, viskosen Masse wie dem Chymus (teilweise verdaute Nahrung gemischt mit gastrointestinalen Sekreten) zu funktionieren. PreSens pCO2 Mikrosensoren in Nadelbauweise erwiesen sich als ideal für diese Art der Anwendung, da die Nadel durch die Wand des Traktes direkt in die gewünschte Position eingeführt werden kann, und eine sequentielle Überwachung von pCO2 in verschiedenen Darmabschnitten möglich ist. Diese Messungen zeigten, dass der pCO2 im Verdauungstrakt selbst von nüchternen Fischen überraschend hoch ist, weit über dem Blutgehalt, und bei Teleostiern nach der Nahrungsaufnahme besonders erhöht ist. Der Verdauungstrakt ist mit feinen Blutgefäßen besonders gut vaskularisiert und erhält einen erheblichen Teil des Herzzeitvolumens. Diese Beobachtungen werfen interessante Fragen darüber auf, wie verhindert wird, dass das systemische Blut sich an diese hohen pCO2-Werte angleicht, was eine schwere respiratorische Azidose auslösen und den Blutsauerstofftransport unterbrechen würde.
Da die Löslichkeit von Sauerstoff in Wasser relativ zur CO2-Löslichkeit sehr niedrig ist, werden Fischkiemen sozusagen hyperventiliert um CO2 abzugeben [1]. Als Ergebnis wird CO2 bis auf einen sehr geringen Gehalt aus dem Blut ausgewaschen, und der Blut-pCO2 liegt normalerweise bei nur wenigen Torr (d. h. weniger als 0,5 kPa oder etwa 0,5 % CO2). Dieser niedrige pCO2 ist entscheidend um den richtigen pH im Blut und den Körperflüssigkeiten einzustellen. Nun steigen die Befürchtungen darüber, wie Fische mit den erhöhten pCO2-Werten in ihrer Umwelt zurechtkommen werden, die voraussichtlich Ende des Jahrhunderts mit dem Klimawandel einhergehen werden (z. B. + 0,75 Torr, + 0,1 kPa oder 0,1 %; [5]), und dem viel höheren pCO2-Gehalt dem sie in intensiver Aquakultur bereits ausgesetzt sind (z. B. + 7,5 Torr, + 1 kPa oder etwa 1 %; [2]). Bei Säugetieren wurde bereits nachgewiesen, dass der pCO2-Gehalt des menschlichen Flatus etwa den 6-fachen pCO2-Gehalt des normalen Blut-pCO2 hat [8]. Falls das gleiche bei Fischen zutrifft, dann könnten sie bereits über physiologische Mechanismen verfügen, die verhindern, dass dieser interne pCO2 sich mit dem des Blutes ausgleicht und die Säure-Basen-Regulierung sowie den Sauerstofftransport stört. Der PreSens faseroptische pCO2 Mikrosensor bot uns eine einzigartige Methode diesen Fragen nachzugehen.
Material & Methoden
Versuchstiere
Fische wurden entweder aus Aquakultur (Süßwasser: Regenbogenforelle Oncorhynchus mykiss und Goldfisch Carassius auratus) oder aus Wildfang (Salzwasser: Englische Scholle Parophrys vetulus und Schleimaal Eptatretus stoutii) bezogen, die letzteren mit einer Fangerlaubnis des Department of Fisheries and Oceans Canada. Die Forelle, der Goldfisch und die Scholle sind Teleostier, während der Schleimaal zu den Agnatha gehört, ein überlebender Vertreter der frühen Craniaten. Die Forelle wurde als ein typischer Fleischfresser ausgewählt, der über einen säurehaltigen Magen verfügt, während der Goldfisch ein Pflanzenfresser ist, dem ein Magen völlig fehlt. Die Seescholle ist ebenfalls ein Fleischfresser mit einem säurehaltigen Magen, wobei auch bekannt ist, dass sie als Teil ihrer osmoregulatorischen Strategie in der Salzwasserumgebung HCO3- in ihrem Darm absondert [4]. Der Schleimaal ist ein Fleischfresser, und hat wie der Goldfisch keinen Magen. Die Fische wurden im Labor bei 12 °C gehalten und entweder ausgehungert, so dass der Verdauungstrakt leer war, oder mit handelsüblichen Pellets (Forelle und Goldfisch), gefrorenem Hering (Scholle), und Tintenfisch (Schleimaal) gefüttert. Die Fische wurden mit neutralisiertem MS-222 (Syndel Laboratories, Parksville, B. C., Kanada) anästhesiert und bei Forellen und Goldfischen wurde ein Katheter in die Dorsalarterie eingesetzt um Blutproben zu entnehmen. Jedes Versuchstier wurde auf einem Operationstisch platziert und kontinuierlich über die Kiemen (Forelle, Goldfisch, Scholle) oder die Nasenöffnung (Schleimaal) mit temperaturkontrolliertem Wasser von 12 °C versorgt (künstlich beatmet), das zusätzlich MS-222 in passender Konzentration für die entsprechende Spezies enthielt, um eine Stufe-5-Anästhesie aufrecht zu erhalten - "Verlust der Reflexaktivität, kompletter Verlust der Reaktionsfähigkeit, schwache Bewegung des Kiemendeckels" [6]. Die Bauchhöhle wurde chirurgisch geöffnet um den Verdauungstrakt freizulegen, der während des gesamten Eingriffs mit physiologischer Kochsalzlösung feucht gehalten wurde. Die durchschnittliche Experimentdauer betrug 3 - 5 Stunden, währenddessen die Fische kontinuierlich weiter atmeten.
pCO2 Messungen
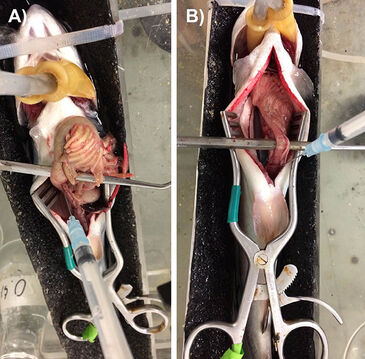
Der faseroptische pCO2 Mikrosensor in Nadelbauweise wurde vor den Versuchen bei experimenteller Temperatur (12 °C) unter Verwendung von 0,9 % oder 3,5 % (Schleimaal) NaCl-Lösung kalibriert; diese wurde mit einer Reihe von CO2-Luft-Gemischen äquilibriert (typischerweise 0,004, 0,1, 0,5, 1, 3 und 5 %, und gelegentlich 10 %), die mit einer 301aF Präzisions-Mischanlage (Wösthoff Messtechnik GmbH, Bochum, Deutschland) erzeugt wurden. Die Kalibrierung dauerte üblicherweise etwa 1,5 Stunden. Zusätzliche Kalibrierkontrollen wurden während und nach den Experimenten durchgeführt. Jeder PreSens Mikrosensor war in eine 23Gx1/4" Injektionsnadel integriert, die mit einer 1-ml-Plastikspritze verbunden war. Die Spritze wurde an einem M33301R Drei-Achsen-Mikromanipulator (World Precision Instruments, Sarasota, FL, USA) angebracht, so dass der Sensor entsprechend positioniert werden konnte. pCO2 Messungen wurden durchgeführt, indem der Nadelmikrosensor in den gewünschten Abschnitt des Verdauungstrakts eingeführt wurde und dann der Spritzenkolben so vorgerückt wurde, dass etwa 1 mm der Sensorspitze freigelegt war. Abb. 1 zeigt die Messdurchführung im mittleren Darmtrakt von 24 Stunden vorher gefütterten (A, man sieht deutlich, dass der Trakt mit Chymus prall gefüllt ist) und > 1 Woche ausgehungerten (B, der Trakt ist leer) Regenbogenforellen. Zusätzlich wurden pCO2 Messungen in Blutproben (0,2 ml) durchgeführt, die frisch über den arteriellen Katheter (Forelle, Goldfisch) oder durch Punktierung der kaudalen Sinusvene (Schleimaal) entnommen wurden. Messungen wurden in 2-Minuten-Intervallen aufgezeichnet, und typische Werte konnten nach 10 - 20 Minuten abgelesen werden, wenn die Messkurve sich stabilisiert hatte.
Ergebnisse und Diskussion
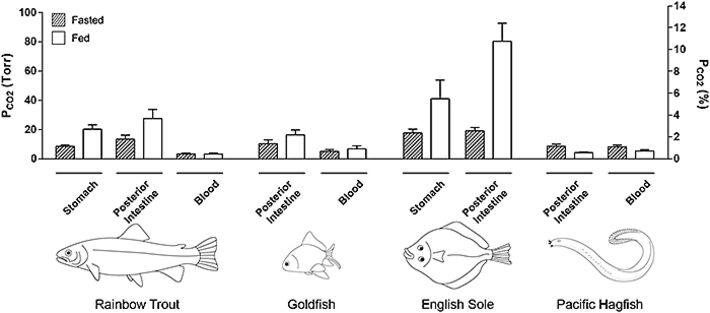
Abb. 2 zeigt repräsentativ ein Experiment mit gefütterten Regenbogenforellen. Man kann erkennen, dass sich die pCO2-Werte an den unterschiedlichen Aufzeichnungsstellen stark unterschieden, aber alle Werte eindeutig höher lagen als im Blut. Die Daten für Magen und Enddarm der vier Spezies wurden zusammengefasst (Abb. 3). Tatsächlich reichte selbst in nüchternen Forellen der pCO2-Bereich von etwa 8,5 Torr im Magen bis zu 13,4 Torr im Darm, im Gegensatz zu normalem Blut-pCO2 von nur 3,3 Torr. Mit Nahrungsaufnahme verdoppelten oder verdreifachten sich generell die pCO2-Werte über den gesamten Verdauungstrakt, mit Mittelwerten von 20,3 Torr im Magen und 27,4 Torr im Enddarm, ohne irgendwelche Veränderungen im Blut-pCO2 (Abb. 3). Bei Süßwasser-Forellen wurden die höchsten Werte im Vorderdarm erreicht, wo bei einigen Tieren 40 Torr überschritten wurden (Daten nicht gezeigt), allerdings nicht bei allen Fischen (siehe Abb. 2). Der magenlose Goldfisch zeigte sehr gleichmäßige pCO2-Werte über sämtliche Abschnitte seines sehr langen Verdauungstraktes, aber auch hier lagen die Werte doppelt oder dreifach über dem normalen Blut-Gehalt, und erhöhten sich bei Nahrungsaufnahme (Abb. 3).
Für Salzwasser-Fische sind die Messungen für die Englische Scholle nur vorläufig (bisher nur zwei gefütterte und zwei nüchterne Tiere und noch keine Blutproben), aber sie deuten darauf hin, dass pCO2-Niveaus in marinen Teleostiern deutlich höher sind als bei Süßwasser-Teleostiern, mit Höchstwerten von etwa 80 Torr im hinteren Darm gefütterter Tiere (Abb. 3). Andererseits zeigte der "primitive" Pazifische Schleimaal, der keinen Magen und einen nur sehr kurzen Verdauungstrakt besitzt, ein komplett unterschiedliches Muster im Vergleich zu den anderen Spezies. pCO2 Werte waren in allen Teilen des Verdauungstraktes homogen, und entsprachen fast exakt den Blutwerten. Interessanterweise zeigte sich hier, anstatt erhöhter pCO2-Werte im Verdauungstrakt nach der Nahrungsaufnahme, genau das Gegenteil, wobei der pCO2-Wert im Darm parallel mit dem des Blutes abfiel (Abb. 3).
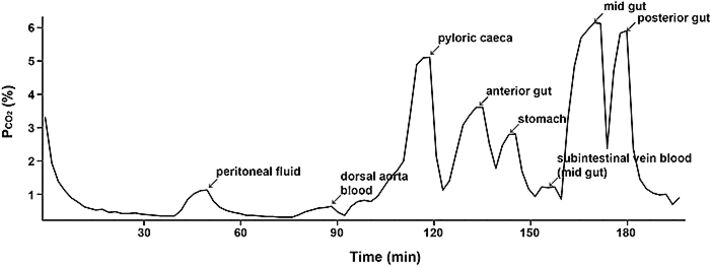
Momentan untersuchen wir die Ursachen für diesen sehr hohen pCO2-Gehalt im Verdauungstrakt von Teleostiern, und warum er sich nach Nahrungsaufnahme erhöht. Unsere derzeitigen Ergebnisse deuten auf eine Vielzahl von CO2-bildenen Vorgängen in Teleostiern hin, einschließlich der Einwirkung von Magensäure und Verdauungsenzymen auf die Nahrungskomponenten, dem Metabolismus des Darm-Mikrobioms, der Absonderung von HCO3- durch das Pankreas und die Darmwand, und die darauf folgende Reaktion mit Bestandteilen des Chymus. Die Englische Scholle scheidet, vor allem nach der Nahrungsaufnahme, sehr viel HCO3- aus, was zeigt, wie wichtig dieser Prozess für die osmoregulatorische Strategie dieser Tiere ist [4], die sie mit den meisten Salzwasser-Teleostiern gemein haben [3]. Der Schleimaal dagegen scheint kein HCO3- in den Verdauungstrakt abzusondern, aber zeigt nach der Nahrungsaufnahme einen ziemlichen Anstieg des O2-Verbrauchs [9]. Vielleicht erklärt der damit verbundene Anstieg der Ventilation auch die niedrigen pCO2-Werte nach der Nahrungsaufnahme. In jedem Fall werfen diese Ergebnisse, gerade im Hinblick auf die extreme Vaskularisierung und den hohen post-prandialen Blutfluss zum Verdauungstrakt [7] interessante Fragen auf. Gleicht sich der hohe pCO2-Gehalt im Chymus über das Blut aus? Spielt er bei der O2-Versorgung der Enterozyten durch den Bohr-und-Root-Effekt eine Rolle [1]? Und wenn ja, wie wird eine schwere respiratorische Azidose im systemischen Blutstrom verhindert? Vorläufige Messungen, wie die niedrigen pCO2-Werte in der subintestinalen Vene der Regenbogenforelle in Abb. 2, lassen vermuten, dass es zu keiner Angleichung kommt, aber falls sich dies bestätigt, wirft es wiederum die Frage auf, wie sie verhindert wird? Der PreSens faseroptische pCO2 Mikrosensor und O2 Mikrosensor werden bei der Beantwortung dieser Fragen eine wichtige Rolle spielen.
Referenzen
[1] Dejours P. (1975), Principles of Comparative Respiratory Physiology. North-Holland Publishing Company, Amsterdam
[2] Good, C., Davidson, J., Welsh, C., Snekyik, K., and Summerfelt, S. (2010), Aquacultural Engineering 42, 51 - 56
[3] Grosell, M. (2011), Fish Physiology, Vol 30. (eds. Grosell, M. G., Farrell, A. P., and Brauner, C. J.) 135 - 164
[4] Grosell, M., De Boeck, G., Johannsson, O., and Wood, C. M. (1999), Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology 124, 259 - 270
[5] Heuer, R. M. and Grosell, M. (2014), American Journal of Physiology, Regulatory, Integrative, and Comparative Physiology 307, R1061 - R1084
[6] McFarland, W. N. (1959), Publ. Inst. Mar. Sci., 6, 23 - 55
[7] Seth, H., Axelsson, M., and Farrell, A. P. (2011), Fish Physiology, Vol. 30 (eds. Grosell, M. G., Farrell, A. P. and Brauner, C. J.) 351 - 393
[8] Suarez, F., Furne, J., Springfield, J., and Levitt, M. (1997), American Journal of Physiology - Gastronintestinal and Liver Physiology 272, G1028 - G1033
[9] Weinrauch, A. M., Clifford, A. M., and Goss, G. G. (2018), Journal of Comparative Physiology B 188, 101 - 112


