Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Hypoxie in statischen und dynamischen 3D-Kultursystemen
Sauerstoffgradientenmessung in 3D-Kultursystemen für das Engineering von Knochengewebe
Elias Volkmer1, Inga Drosse1, Sven Otto2, Achim Stangelmayer3, Michael Stengele1, Bobby Cherian Kallukalam1, Wolf Mutschler1, und Matthias Schieker1
1Experimental Surgery and Regenerative Medicine, Department of Surgery, LMU München, Deutschland
2Department of Oral and Maxillofacial Surgery, LMU München, Deutschland
3PreSens Precision Sensing GmbH, Regensburg, Deutschland
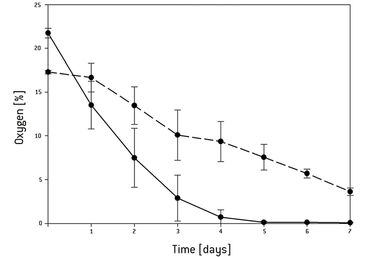
Gradienten in der Gewebequalität von der Peripherie zum Zentrum hin sind ein limitierender Faktor beim Tissue Engineering und der Herstellung von größeren Zellgerüsten. Ungleichmäßige Sauerstoffversorgung könnte die Ursache für unregelmäßiges Zellwachstum auf den Gerüsten sein. In dieser Studie wurden kontinuierliche Messungen der Sauerstoffkonzentration in der Mitte von Gerüsten, die für das Knochengewebe-Engineering entworfen wurden, und dem umgebenden Medium durchgeführt. In statischen 3D-Kultursystemen fiel die Sauerstoffkonzentration im Zentrum nach 5 Tagen auf 0 % und führte zum Zelltod. Perfusions-Bioreaktoren können zwar den Zelltod verhindern, aber 3D-Kultur-assoziierte Sauerstoffgradienten nicht vollständig eliminieren.
In vitro Engineering von Knochengewebe in klinisch relevanten Maßstäben war bisher nicht erfolgreich. Mit zunehmender Größe der zellbesiedelten Gerüste treten inhomogene zelluläre Proliferation und Differenzierung, von den äußeren Bereichen der Gerüste zum Zentrum hin, auf. Je größer die zellbesiedelten Gerüste sind, desto schwieriger ist es, alle Zellen gleichmäßig mit Nährstoffen und Sauerstoff zu versorgen. Diese Studie untersuchte, ob 3D-Kultursysteme, die üblicherweise für das Knochengewebe-Engineering verwendet werden, im Allgemeinen von Sauerstoffgradienten beeinflusst werden und ob diese Gradienten einen Einfluss auf das Zellüberleben innerhalb des Konstrukts haben. Chemisch-optische Sauerstoff-Mikrosensoren (PreSens GmbH, Regensburg, Deutschland) wurden zur Messung von Sauerstoffkonzentrationen im Zentrum dynamischer und statischer 3D-Kultursysteme eingesetzt.
O2-Konzentrationsmessungen
Ein Subklon der murinen Präosteoblastenzellinie MC3T3-E1 (DSZM, Braunschweig, Deutschland) wurde in minimal essentiellem Medium alpha mit L-Glutamin (Invitrogen, Carlsbad, CA) expandiert, das mit 10 % fetalem Rinderserum (FBS; Sigma, München, Deutschland) und 40 IE/ml Penicillin/Streptomycin ergänzt wurde. Die Zellen wurden in einer befeuchteten Atmosphäre von 95 % Luft mit 5 % CO2 bei 37 ºC gehalten und dreimal wöchentlich mit frischem Medium versorgt. Zylindrische, sterilisierte, demineralisierte Rinderknochenmatrix-Gerüste (DBM; Tutogen Medical, Neunkirchen, Deutschland) von 9 mm Durchmesser und 5 mm Höhe dienten als Matrix in allen Experimenten. 666 µl Zellsuspension (ungefähr 7,5 × 104 Zellen/ml) wurden auf die Gerüste übertragen. Nadel-Sauerstoff-Mikrosensoren mit fester Sensorspitze (PreSens) wurden für Sauerstoffmessungen in den 3D-Kulturen verwendet. Für die statische Kultur wurden die besiedelten Gerüste in einem Standard-Zellkulturinkubator in 24-Well Platten gehalten. Um den Sauerstoffpartialdruck in statisch gezüchteten Gerüsten kontinuierlich zu überwachen, wurde der nadelförmige Sensor durch ein selbst hergestelltes Loch im Deckel der Kulturplatte geführt und genau in der Mitte des frisch ausgesäten Gerüsts in einer Tiefe von 2,5 mm platziert . Der Sauerstoff wurde jede Stunde über einen Zeitraum von 7 Tagen gemessen. Um Sauerstoff im Medium zu messen, wurde eine weitere Sauerstoffsonde neben dem Gerüst eingesetzt. Für die dynamische 3D-Kultur wurden zwei Aufbauten der Perfusionsbioreaktor-Kultur verwendet: In der Standard-Perfusionsanordnung konnte das Medium um das Gerüst fließen, da die Durchflusskammer einen größeren Durchmesser als das verwendete Gerüst hatte. Für einen erzwungenen Perfusionsaufbau wurden Trägerkassetten aus Polycarbonat konstruiert, die die Gerüste passgenau hielten und exakt in die Flusskammer passten. Auf diese Weise wurde das Kulturmedium durch das Gerüst gedrückt. Die Bioreaktoren wurden über gasdurchlässige Silikonröhrchen mit frischem Medium versorgt, das 25 mM HEPES-Puffer (PAA) enthielt, und mit Abfallreservoirs verbunden. In der Standard-Perfusionsanordnung wurde der Sauerstoff-Mikrosensor auf halber Höhe in einer Tiefe von 4,5 mm in der geometrischen Mitte des Konstrukts angeordnet. Zur Sauerstoffmessung in der erzwungenen Perfusion wurden in die Seite der Polycarbonat-Kassette Löcher gebohrt, um die Sauerstoffsonde einzuführen und in der Mitte des Gerüsts zu platzieren. Zur Messung von Sauerstoff im Medium der Perfusionsbioreaktorkulturen wurden zusätzliche Sauerstoffsonden eingesetzt, eine in das zuführende und eine in das efferente Medium. Das Überleben der Zellen wurde mittels Fluoreszenzmikroskopie basierend auf Inkubation von Zellen mit Fluorescein-Diacetat (FDA) und Propidiumiodid (PI) (Fluka / Sigma, München, Deutschland) bewertet.
Hypoxie in 3D-Kultur
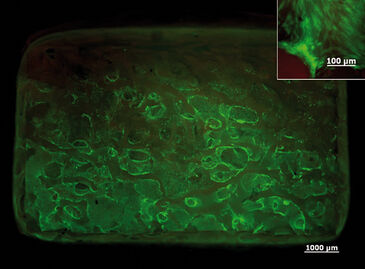
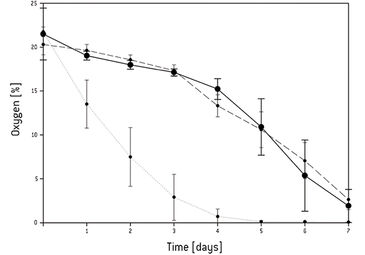
Die kontinuierliche Sauerstoffmessung in der statischen 3D-Kultur ergab, dass sich ein Sauerstoffgradient von der Oberfläche des 3D-Konstrukts zum Zentrum hin gebildet hatte. Nach 5 Tagen fiel die Sauerstoffkonzentration in der Mitte des Gerüsts auf 0 % und im umgebenden Medium auf 4 % (Abb.1). Das Live-Dead-Assay zeigte, dass nach 3 Tagen Kultivierung alle Zellen noch lebensfähig waren. Auch nach 5 Tagen waren noch die meisten Zellen am Leben, obwohl die Sauerstoffkonzentration auf bis zu 1 % abfiel. Nach 7 Tagen waren der Kern und die Basis des Gerüstes voller toten Zellen. In der Mitte der Standardperfusionskultur waren im Vergleich zu statischen Kulturbedingungen nach 7 Tagen weniger Zellen abgestorben. Bei der Wiederholung des Experiments unter den gleichen Bedingungen in der erzwungenen Perfusion, zeigte die Lebend-Färbung, die nach 7 Tagen durchgeführt wurde, dass in diesem Aufbau noch mehr Zellen in der Mitte und der Peripherie des Gerüsts gewachsen waren. Nur im oberen Bereich des Gerüsts schienen weniger Zellen gewachsen zu sein. Eine stärkere Vergrößerung des jeweiligen Bereichs zeigte jedoch eine verminderte, aber zufriedenstellende Zellproliferation (Abb. 2). In der erzwungenen Perfusionskultur konnten Sauerstoffkonzentrationen von 20 % am Einlass und etwa 12,5 % am Auslass gemessen werden. Aber in beiden dynamischen Kulturaufbauten war der Sauerstoffgehalt in der Mitte auf 4 % abgesunken (Abb. 3).
Zusammenfassung
Zellen mit hohem Proliferationspotenzial erzeugen, wenn sie für 3D-Kultur verwendet werden, einen Sauerstoffgradienten innerhalb der Gerüste. Daten, die in dieser Studie unter Verwendung einer schnell wachsenden Mauszelllinie erfasst wurden, können nicht direkt auf menschliche Zellen übertragen werden. Diese Zellen wurden ausgewählt, da sie üblicherweise als Modellzelllinie zur Beurteilung des Knochenzellmetabolismus verwendet werden. Darüber hinaus können mit diesen schnell wachsenden Zellen die verschiedenen Kulturstrukturen bis an die Grenzen getestet werden, so dass sogar Einschränkungen in der dynamischen 3D-Kultur entdeckt werden könnten. Statische 3D-Kultur erwies sich als nicht anwendbare Methode zur Erzeugung von Gewebe. Die Flow-Perfusion verbessert die Sauerstoffversorgung der Zellen und fördert somit die Zellproliferation. Dennoch ist die Sauerstoffkonzentration im Zentrum der dynamischen Kultur deutlich niedriger als am Einlass und Auslass des Bioreaktors, so dass eine Sauerstofflimitierung nicht vollständig beseitigt und eine homogene Sauerstoffversorgung nicht gewährleistet ist. Die Herstellung von beträchtlichen Mengen an Gewebe erfordert eine sorgfältige Überwachung des Sauerstoffgehalts in den Zellgerüstkonstrukten. Die Messung der zentralen Sauerstoffkonzentration scheint eine Mindestanforderung für alle Gerüst-basierten Tissue-Engineering-Aktivitäten zu sein.
Applikationsbericht nach
Volkmer et al., 2008, Hypoxia in Static and Dynamic 3D Culture Systems for Tissue Engineering of Bone, Tissue Eng: Part A 14, No. 8