Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Kultivierung von Insektenzellen in orbital geschüttelten Kolben mit Sensoren
Sauerstoff-Massentransfer in Insektenzellkulturen mit hoher Zelldichte
N. Riesen, C. Ries, R. Eibl, D. Eibl
Züricher Hochschule für Angewandte Wissenschaften, Life Science und Facility Management, Institut für Biotechnologie, Bioverfahrens- und Zellkulturtechnik, Wädenswil, Schweiz
Prozesse basierend auf Insektenzellen haben in den letzten Jahren bei der Werkzeugprotein- und VLP (Virus-like Particle) -Impfstoffproduktion zunehmend an Einfluss gewonnen. In kleinem Maßstab werden Insektenzellen normalerweise in nicht-instrumentierten, orbital geschüttelten Einwegkolben, in den meisten Fällen Erlenmeyerkolben, gezüchtet, um Seedtrain-Produktionen und frühe Verfahrensentwicklungsprozesse durchzuführen. Der Shake Flask Reader mit nicht-invasiven optischen Sensoren für pH und DO ist ein wichtiger Beitrag zur einfachen Quantifizierung des Sauerstoff-Massentransfers in Erlenmeyerkolben. Zusätzlich erlaubt er eine kontrollierte Prozessdurchführung im ml-Maßstab, wie es hier für die beschriebenen Sf-9- und Sf-21-Zellmassenpropagierung beispielhaft dargestellt ist.

Insektenzellen und ihre Eigenschaften
Seit den frühen 1970er Jahren wurde die Eignung von Insektenzellen (in Verbindung mit dem Baculovirus Expressionvector System, BEVS) zur Herstellung komplexer Proteine, die in Strukturanalysen, funktionellen Studien, und bei der Herstellung von Diagnostika und Impfstoffen verwendet werden, in zahlreichen Artikeln und Reviews beschrieben. Die angewandten Produktionszelllinien (Sf-9, Sf-21 und BTI-TN-5B1-4, auch bekannt als High Five™ oder Trichoplusia ni-Zelllinie) stammen von Spodoptera frugiperda und der Aschgrauen Höckereule (Trichoplusia ni). Selbst im Batch-Modus, bei Temperaturen zwischen 27 °C und 28 °C und einem pH-Wert zwischen 6,2 und 6,9, wachsen diese Zellen zu hohen Zelldichten (> 1 × 107 Zellen ml-1) heran. Dazu ist es natürlich notwendig, dass ein optimiertes serumfreies Kulturmedium vorhanden ist, das das Zellwachstum unterstützt, sowie geeignete Kultivierungssysteme, die Schäden durch Scherkräfte verhindert und eine ausreichende Sauerstoffversorgung gewährleisten. Der Parameter, der den Sauerstofftransfer in einem Kultivierungssystem charakterisiert, ist der kLa-Wert (auch bekannt als Sauerstofftransferkoeffizient).
Bestimmung der kLa-Werte
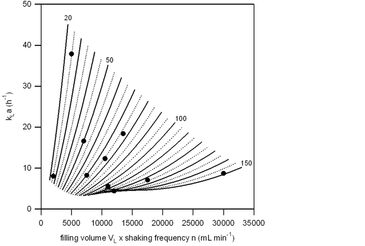
Zur Bestimmung der kLa-Werte der Schüttelkolben von PreSens (250 ml Gesamtvolumen, Standardbelüftungskappen) wurden sie mit dem PreSens SFR (www.presens.de/SFR) ausgelesen. Die SFR-Einheit, die in einem Schüttelinkubator Ecotron (25 mm Schütteldurchmesser) von Infors montiert war, verfügt über neun optische Doppelmodule, die eine kabellose Echtzeitüberwachung und Anzeige von pH- und Sauerstoffwerten ermöglichen. Unter Verwendung der bekannten Standard-Ausgasungsmethode (siehe Abb. 1) wurden neun verschiedene Experimente (statistisch mit STAVEX 5.0-Software entworfen) bei variierenden Füllvolumina (zwischen 25 - 150 ml) sowie Schüttelfrequenzen (zwischen 80 - 200 U/min) durchgeführt. Alle Kolben liefen mit Sf-900 III SFM von Gibco Invitrogen bei einer Temperatur von 27 ºC. DO-Konzentrationen wurden über die Zeit aufgezeichnet, und experimentell sowie über STAVEX 5.0-Modell abgeleitete kLa-Werte wurden berechnet, wie es bei Ries et al. [1] im Detail beschrieben ist. Bei ausgewählten Kultivierungsparametern lagen die experimentellen kLa-Werte zwischen 4,4 und 37,9 pro Stunde; diese Werte stimmen gut mit den im Modell ermittelten Sauerstofftransferdaten überein (Abb. 2).
Sauerstofftransferstudien während der Massenpropagation
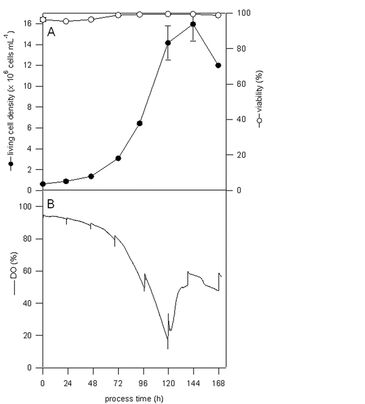
Die Massenvermehrungen von Sf-9- und Sf-21-Zellen wurde in 250 ml Schüttelkolben durchgeführt, die mit integrierten und vorkalibrierten pH- und DO-Sensoren von PreSens ausgestattet waren. Sie dauerten zwischen sieben und acht Tage, wobei die Kolben mit 100 ml Sf-900 III SFM gefüllt, mit 5 × 105 Zellen ml-1 inokuliert und bei 27 °C und 110 U/min inkubiert wurden. Unter diesen Bedingungen kann ein Sauerstofftransferkoeffizient von 5,6 pro Stunde angenommen werden. Die Probenahme erfolgte auf zwei verschiedene Arten. In Versuchsreihe 1 (Sf-9-Zellmassenvermehrung) wurde an jedem Kultivierungstag eine Probe aus allen Kolben entnommen, während in Versuchsreihe 2 (Sf-21-Zellmassenvermehrung) pro Tag nur eine Probe aus einem Kolben entnommen wurde. Die Probenanalysen umfassten Messungen der Lebendzelldichte und -lebensfähigkeit (mit NucleoCounter von Chemometec und Cedex HiRes von Innovatis) und Offline-Bestimmungen von pH, Glucose, Lactat, Ammonium, Glutamin, und Glutamat (mit BioProfile 100 von Nova Biomedical). Abb. 3 zeigt einen DO-Verlauf aus Versuchreihe 1, der durch Probennahme bzw. Öffnen des sterilen Verschlusses beeinflusst wurde, wobei am sechsten Tag der Kultivierung eine maximale Lebendzelldichte von 1,6 · 107 Zellen ml-1 erreicht war. Es kann jedoch keine klare Aussage zu möglichen Massentransferbeschränkungen gemacht werden. Aus Ergebnissen der Versuchsreihe 2, in denen ein nicht beeinflusster DO-Verlauf garantiert werden konnte, ist offensichtlich, dass das Zellwachstum von Sf-21-Suspensionszellen bei Sauerstoffsättigung unter 10 % endete [1]. Aufgrund der Tatsache, dass diese Beobachtung mit denen anderer Gruppen übereinstimmt und Wachstumsinhibition aufgrund des Kulturmediums unserer Erfahrung nach unwahrscheinlich war, nehmen wir an, dass es am fünften Kultivierungstag zu einer Sauerstofflimitierung kam. Interessanterweise ist dies die Zeit unmittelbar vor Erreichen der maximalen Lebendzelldichte, die wiederum 1,6 × 107 Zellen ml-1 betrug. Die online pH-Daten entsprachen in beiden Versuchsreihen gut denen von offline gemessenen Proben.
Zusammenfassung
Unsere Ergebnisse zeigen wie vorteilhaft PreSens Schüttelkolben, die nicht-invasive pH- und DO-Messungen ermöglichen, für die Prozesscharakterisierung und eine optimierte Durchführung von Insektenzellkulturen in kleinem Maßstab sind. Sauerstoff ist das Schlüsselelement für Wachstum mit hoher Zelldichte bei der Seed Train Produktion, und für hohe Produkttiter, die bei der Proteinproduktionen angestrebt werden.
[1] Ries C, John G, John C, Eibl R, Eibl D (2010), A shaken disposable bioreactor system for controlled insect cell cultivations at millilitre-scale, Life Science Engineering
Vol. 10 (1), pp. 75 - 79