Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Online Sauerstoffüberwachung in Zellkultur
Effekt von mitochondrialen Modulatoren auf die O2-Dynamik von Säugerzellen
Lynn S. G. und LaPres J. J.
Dept. of Biochemistry, Michigan State University, East Lansing, MI, USA
Echtzeitmessungen von Sauerstoff und pH in Säugetierzellkulturen sind wichtig, um die metabolische Dynamik in diesen Kulturen zu verstehen. Der SDR SensorDish® Reader ermöglicht es, den zeitlichen Verlauf des zellulären Sauerstoffverbrauchs als Antwort auf Umweltbedingungen oder toxikologische Angriffe zu verfolgen. Diese Art der Überwachung könnte auch für andere Anwendungen wie Tissue Engineering und Stammzellenforschung nützlich sein.
Der SDR SensorDish® Reader (Abb. 1) ermöglicht die nicht-invasive Online-Überwachung von Sauerstoff und pH in 24-Well Mikrotiterplatten. In der vorliegenden Arbeit wurde der SDR zur Überwachung des Sauerstoffgehalts in Medien verwendet, die bei 4 verschiedenen Zelldichten und variierender Sauerstoffspannung (19% O2, Abb. 2, und 7% O2, Abb. 3) plattiert waren. Zusätzlich wurden die O2-Verbrauchsraten als Reaktion auf mitochondriale Modulatoren (Abb. 4) bewertet. Embryonale Fibroblasten der Maus (MEFs) wurden als repräsentativer Säugetierzelltyp verwendet, Carbonylcyanid m-Chlorphenylhydrazon (CCCP) wurde als metabolischer Entkoppler und Antimycin als Elektronentransportketteninhibitor verwendet.
Material & Methoden
Embryonale Fibroblasten der Maus (MEF) wurden in 24-Well Mikrotiterplatten mit integrierten Sauerstoffsensoren (OxoDishes ®) kultiviert. Die Zellen wurden unter Standardzellkulturbedingungen (5 % CO2, 35 % Feuchtigkeit und 37 °C) in Dulbecos modifiziertem Eagle-Medium (DMEM) gehalten, dem 10 % hitzeinaktiviertes fetales Rinderserum (FBS), 1 % Penicillin (10.000 U/ml) / Streptomycin (10.000 μg / ml), 1 % L-Glutamin (200 mM), 1 % nichtessentielle Aminosäuren (10 mM) und 1 % 1 M HEPES (pH 7,8) zugesetzt waren. In allen Fällen wurden die Zellen in 1 ml Medium/Well in einer Coy O2 Controlled Glove Box kultiviert. Die Sauerstoffkonzentration im Kulturmedium wurde während der gesamten Kultivierungszeit in voreingestellten Intervallen mit der SensorDish ® Reader Software überwacht.
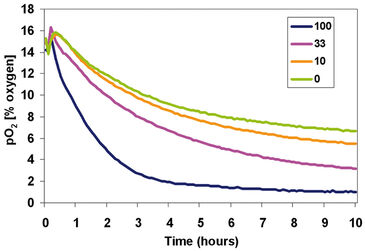
Auswirkungen der Zelldichte
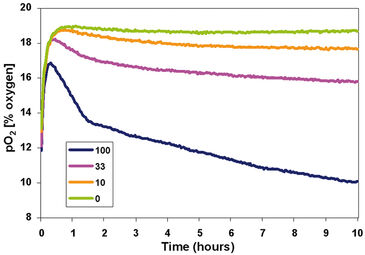
Das erste Experiment wurde entwickelt, um die Auswirkungen der Zelldichte auf die zelluläre Sauerstoffverbrauchsrate und die nachfolgenden pO2-Niveaus in den Medien zu untersuchen. MEF-Zellen wurden in drei getrennten Konzentrationen (100.000, 33.000 und 10.000 Zellen/cm2) zusammen mit einer "Nur-Medium"-Kontrolle ausplattiert. Die Messungen wurden alle 2 Minuten für 10 Stunden bei nahezu atmosphärischem Sauerstoffgehalt (etwa 19 % O2) durchgeführt. Das Sauerstoffprofil (Abb. 2) zeigt deutlich die Auswirkung der Zelldichte auf den O2-Verbrauch jeder Behandlung. Eine Verzögerung von < 1 Stunde wurde beobachtet, vermutlich während sich das System auf Temperatur und Sauerstoffgehalt anpasste. Nach diesem Zeitraum zeigten alle Zellkonzentrationen eine Abnahme des pO2 Gehaltes im Vergleich zum Kontroll-Well. Schließlich war im Verlauf der Inkubation die Abweichung von den Kontroll-Wells proportional zu der Anzahl der ursprünglich ausplattierten Zellen, was impliziert, dass die individuelle Zellatmung bei allen getesteten Zelldichten äquivalent war. Das zweite Experiment wurde entwickelt, um die Auswirkungen von niedrigen Sauerstoffkonzentrationen auf die durch Zelldichte verursachten Beobachtungen aus dem ersten Experiment zu untersuchen. MEF-Zellen wurden in drei verschiedenen Konzentrationen (100.000, 33.000 und 10.000 Zellen/cm2) zusammen mit einer "Nur-Medien"-Kontrolle ausplattiert und dann in eine 7 % O2-Atmosphäre gegeben und alle 5 Minuten für 10 Stunden überwacht. Das Sauerstoffprofil bestätigte den Effekt der Zelldichte auf den O2-Verbrauch jeder Behandlung (Abb. 3). Es wurde eine kurze Periode des Temperaturausgleichs (< 1 Stunde) beobachtet, wonach der Restsauerstoff in den Medien in einer Zelldichte-abhängigen Weise verbraucht wurde. Interessanterweise war sogar das Kontroll-Well nach 10 Stunden nicht vollständig zum neuen O2-Gehalt von 7 % O2 äquilibriert. Jedoch war die Abweichung von den "nur Medien"-Kontrollen bei jeder Behandlung proportional zur Anzahl der ausplattierten Zellen.
Auswirkungen mitochondrialer Modulatoren
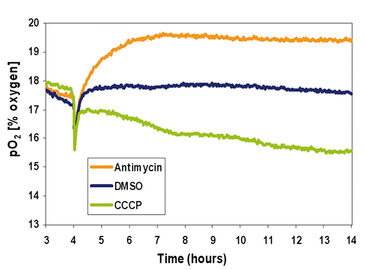
Das dritte Experiment wurde entwickelt, um die Effekte spezifischer mitochondrialer Modulatoren auf den zellulären Sauerstoffverbrauch und die nachfolgenden pO2-Niveaus in den Medien zu untersuchen. MEF-Zellen wurden mit 33.000 Zellen/cm2 ausplattiert und konnten für 4 Stunden an der Kulturschale anhaften. Das Kulturmedium wurde dann durch das behandlungsspezifische Medium ersetzt, das entweder 1 µl/ml Dimethylsulfoxid (DMSO, Vehikelkontrolle), 10 µM Carbonylcyanid-m-chlorphenylhydrazon (CCCP), oder 10 µM Antimycin enthielt. Jedes Well wurde dann mit 1 ml Mineralöl bedeckt, die Platte unter Standardkulturbedingungen (5 % CO2, 35 % Feuchtigkeit, 37 °C und 19 % O2) inkubiert und alle 2 Minuten 10 Stunden lang überwacht. Das Sauerstoffprofil zeigt einen ausgeprägten Effekt der Behandlungen auf den O2-Verbrauch der Zellen (Abb. 4). Messungen von der dritten bis zur vierten Stunde zeigten, dass es vor der Aufnahme der dosierten Medien wenig Unterschiede in den verschiedenen Ansätzen gab. Innerhalb von 30 Minuten nach der Dosierung zeigten sich beobachtbare Unterschiede in den Sauerstoffverbrauchskurven der unterschiedlichen Ansätze. DMSO, die Vehikelkontrolle, verursachte eine geringe Veränderung des durchschnittlichen O2-Niveaus in den MEF-Zellen. Es bildete sich ein Gleichgewichtszustand zwischen Sauerstoffverbrauch und Sauerstoffeintritt bei etwa 17,5 % O2. Antimycin, ein Inhibitor des Komplexes III der Elektronentransportkette, führte zu einer beobachtbaren Abnahme der Sauerstoffverbrauchsrate der Zellen, was zu einem Gleichgewichtszustand führte, der höher lag als der mit DMSO. Schließlich führte die Behandlung mit CCCP, einem mitochondrialen Entkoppler, zu einem beobachtbaren Anstieg des zellulären Sauerstoffverbrauchs.
Zusammenfassung
Mit dem SDR SensorDish® Reader beobachteten wir den Sauerstoffgehalt in Säugetierzellkulturen und zeigten einen von der Zelldichte abhängigen Sauerstoffverbrauch. Die bei 19 % O2 beobachteten Zelldichte-abhängigen Unterschiede wurden auch bei 7 % O2 beobachtet, einem physiologisch relevanteren Sauerstoffgehalt. Außerdem benötigten Zellkulturmedien ohne Zellen mehr als 10 Stunden, um ein Gleichgewicht zu erreichen, wenn sie 7 % O2 ausgesetzt wurden. Daher empfehlen wir eine Vorinkubation des Mediums bei dem gewünschten Sauerstoffniveau. Schließlich wurde beobachtet, dass CCCP den zellulären Sauerstoffbedarf erhöhte, während Antimycin den zellulären Sauerstoffbedarf im Vergleich zur Vehikelkontrolle verringerte. Der SDR SensorDish® Reader ermöglichte eine konstante und schnelle Quantifizierung des Sauerstoffgehalts in den Medien, der als Maß für den Sauerstoffbedarf und die metabolische Funktion der Zellen verwendet werden kann.