Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Prozessüberwachung in suspensionsadaptierten CHO-Zellkulturen
Nicht-invasive Online-Messung von pH und Sauerstoff
Harry Abts1 und Sarina Arain2
1Celonic GmbH, Karl-Heinz-Beckurts-Straße 13, Jülich, Deutschland
2PreSens GmbH, Am Biopark 11, 93053 Regensburg, Deutschland
Die Online-Erfassung von Sauerstoff und pH in kleinem Maßstab unter Verwendung des SDR kann als Grundlage für die spätere Kultivierung in großem Maßstab in Bioreaktoren verwendet werden, um optimale Wachstumsbedingungen zu ermitteln. Das kontaminationsfreie Online-Monitoring von Kulturparametern ist nicht nur für das Hochskalieren der Produktion in der Prozessentwicklung wichtig, sondern könnte auch für andere Anwendungen wie Tissue Engineering, Stammzellenforschung und toxikologische Tests nützlich sein.
Suspensionsadaptierte Chinesische Hamster Ovarialzellen (CHO-S) werden in der biotechnologischen Produktion von rekombinanten Proteinen häufig verwendet. In der Tat sind solche speziellen Zelllinien zum Standard für diese Art der biopharmazeutischen Produktion geworden, unter anderem wegen ihrer schnellen Reproduktion, der hohen Proteinexpressionsrate im Vergleich zu anderen eukaryotischen Zellen, und vor allem wegen der von den Zellen erzeugten Glykosylierungsmuster. Die effiziente Produktion von korrekt prozessierten Proteinen erfordert optimierte Kultivierungsparameter. Der SensorDish® Reader (SDR) bietet eine nicht-invasive Online-Detektionsmethode, die erstmals eine quantitative Charakterisierung von pH-Wert und Sauerstoff in 24-Well Platten ermöglicht. Bei CHO-S Zellkulturproben mit verschiedenen Startkonzentrationen konnte eine Korrelation zwischen Zellzahl, Sauerstoffverbrauch und pH-Wert während der Zellkultivierung nachgewiesen werden.
Überwachung der CHO-S Zellatmung
Die CHO-Zellen, die in diesen Experimenten verwendet wurden, stammten von der Celonic GmbH, Deutschland, die diese Studie auch durchführte. Die Zelllinie (CHO-S) wurde an Suspensionskultur angepasst. Diese Zellen haben eine hohe Stoffwechselrate und wachsen serumfrei, um Zellkonzentrationen von bis zu 2 × 106 Zellen/ml zu erreichen. Die Kultivierung in einem definierten Medium wurde über 12 Tage unter Standardbedingungen im Brutschrank durchgeführt (5 % CO2, 95 % Luftfeuchtigkeit und 37 °C). Vier verschiedene Zellkonzentrationen (50, 2 × 103, 2,5 × 104 und 3,2 × 105 Zellen/ml) wurden parallel getestet, um die Empfindlichkeit des Systems hinsichtlich der Nachweisgrenze je Probenzellzahl zu untersuchen. Medienwechsel wurden in Intervallen von 24 Stunden durchgeführt. Die Zellen wurden direkt in einem 24-Well HydroDish® (zur pH-Überwachung) und einem 24-Well OxoDish® (zur Sauerstoffdetektion) kultiviert. Die optischen Sensoren befinden sich am Boden jedes Wells und werden nicht-invasiv mit dem SDR ausgelesen. Zwei der 24-Kanal-Ausleseeinheiten wurden verbunden, um gleichzeitig Sauerstoff und pH aufzuzeichnen. Das OxoDish® und HydroDish® wurden jeweils auf einem SensorDish® Readern platziert, die während des gesamten Kultivierungszeitraums im Inkubator belassen wurden. Die SensorDishes® wurden nur für den täglichen Medienwechsel vom SDR genommen. So konnten während des gesamten Kultivierungszeitraums optimale Bedingungen für die Zellen im Brutschrank gewährleitet werden. Messungen wurden automatisch in Intervallen von 10 Minuten durchgeführt. Ein Well mit Kulturmedium ohne Zellen diente als Referenz. Jede Zellkonzentration wurde in einer Vertiefung des OxoDish® bzw. HydroDish® mit einem Probenvolumen von 1,2 ml/Well ausgebracht.
Nicht-invasive pH Überwachung
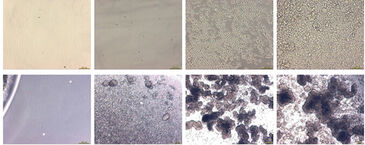
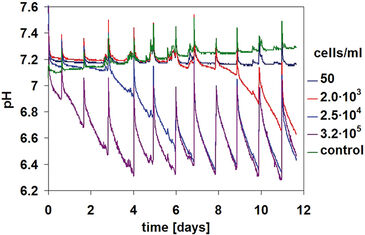
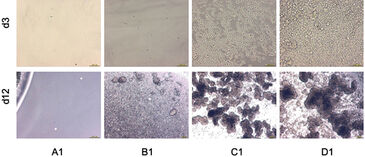
Abbildung 1 zeigt die pH-Kinetik, die während der CHO-S-Zellkultivierung beobachtet wurde. Abhängig von der anfänglichen Zellkonzentration nahmen die pH-Werte mit unterschiedlichen Geschwindigkeiten ab. Die Probe mit der höchsten Ausgangskonzentration (3,2 × 105 Zellen/ml) zeigte bereits am ersten Tag eine signifikante pH-Abnahme, die sich an den folgenden drei Tagen mit steigender Tendenz fortsetzte. Der pH-Wert nahm kontinuierlich von einem anfänglichen Wert von pH 7,2 auf einen endgültigen pH-Wert von 6,3 ab. Aufgrund der täglichen Medienwechsel wurde kein niedrigerer pH-Wert erreicht. Die Kinetik für Proben mit niedrigeren Anfangszellkonzentrationen zeigte ein ähnliches Verhalten: Die pH-Werte nahmen mit einer Verzögerung von drei Tagen (für 2,5 × 104 Zellen/ml) bzw. sechs Tagen (für 2 × 103 Zellen/ml) ab. Und für die niedrigste Ausgangskonzentration von 50 Zellen/ml wurde keine signifikante pH-Änderung des Mediums beobachtet. Der Beginn der pH-Abnahme korrelierte daher direkt mit der Anfangskonzentration von CHO-S Zellen, was auch in Mikroskopaufnahmen zu sehen ist (Abb. 2).
Sauerstoffverbrauch
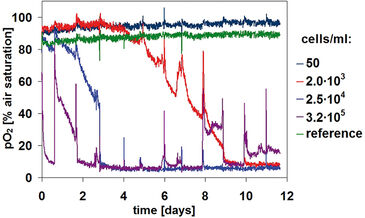
Der Sauerstoffverbrauch hing direkt von der Zellkonzentration und dem Stoffwechselstatus der Kultur ab (Abb. 3). Für die höchste Zelldichte von 3,2 × 105 Zellen/ml fiel der Sauerstoffgehalt innerhalb weniger Stunden von einem Startwert von 90 % Luftsättigung auf nur noch etwa 9 %. Dieser drastische Effekt wurde nach jedem Medienwechsel beobachtet. Nach etwa fünf Tagen fiel der Sauerstoffgehalt auf 6 %, während ab dem 10. Tag ein leichter Anstieg festgestellt wurde. Wir nehmen an, dass die Abweichung der Sauerstoffwerte nach dem Medienwechsel nach einem Tag auf ein versehentliches Entfernen von Zellen während dieser Prozedur zurückzuführen ist. Proben mit niedrigeren Zellkonzentrationen zeigten eine ähnliche Kinetik mit einer Verzögerung von etwa 12 Stunden bzw. vier Tagen. Die Sauerstoffaufnahmerate stieg bei jedem Medienwechsel an. Aufgrund der hohen Stoffwechselrate von CHO-S Zellen wurden nach einem Medienwechsel relativ schnell wieder geringe Sauerstoffkonzentrationen erreicht. Mikroskopisch ermittelte Daten bezüglich Zelldichte und Struktur (Abb. 2) gaben weitere Informationen über die spezifische Kinetik: Die zwei höheren Konzentrationen bildeten über längere Kultivierungsdauer Zellaggregate (Abb. 2, Well C1 und D1 an Tag 12), was die Sauerstoffkinetik auf zwei Arten beeinflusste: Erstens könnten Zellkomplexe während des Medienwechsels entfernt worden sein. Zweitens ist es sehr wahrscheinlich, dass Aggregatstrukturen den Zellstoffwechsel zunehmend hemmen, was wahrscheinlich der Grund für den Anstieg des Sauerstoffs auf ein Niveau von 15 % Luftsättigung vom 10. Tag an war. Wie bei der pH-Überwachung war bei der Kultur mit der niedrigsten Zelldichte keine Stoffwechselaktivität nachweisbar. Bei diesem Experimentaufbau kompensierte der Sauerstoffeintrag in die Probe aus der Umgebungsluft den Sauerstoffverbrauch der Zellen vollständig. Die Kinetik erlaubt die Abschätzung einer Nachweisgrenze bei 8 × 103 Zellen/ml, wobei für niedrige Zelldichten eine Verdopplungszeit von 35 Stunden angenommen wird. Der Sauerstoffgehalt zu Beginn der Kultivierung lag innerhalb der OxoDish®-Auflösung von ± 5 % Luftsättigung. Wie bei den pH-Messungen zeigte die Kontroll-Probe für die Sauerstoffmessung während der Dauer der Kultivierung stabile Werte.
Zukünftige Anwendungen
Dieser erfolgreiche Sensitivitätstest ist die Grundlage für neue Studien mit empfindlicheren Zelltypen. Dazu zählen z. B. humane Chondrozyten, Keratinozyten und Hepatozyten, die für Studien in der regenerativen Medizin verwendet werden. Ein weiterer Anwendungsbereich ist die Stammzellforschung. Hier können genau definierte Sauerstoffniveaus während der in vitro Entwicklung überwacht und gegebenenfalls geregelt werden. Das Aufzeichnen der Sauerstoffkinetik ermöglicht auch neue Anwendungen in der Pharmakologie und Toxikologie, z. B. mit HeLa-Zellen oder primären Zelllinien. Die zytotoxische Wirkung neuer Wirkstoffe kann schnell und quantitativ untersucht werden.
Applikationsbericht nach
BioProcess International (1/2008, 64-66 )