Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Feedback-gesteuerte Kohlenstoff-Zufuhr im Schüttelkolben-Maßstab
Online-Messungen des DO mit chemisch-optischen Sensoren von PreSens

Manuela Senn und Martin Ischebeck
DSM Nutritional Products GmbH, Grenzach-Whylen, Deutschland
In dieser Studie wurde ein feedbackgesteuertes Scale-Down Modell im Schüttelkolben-Maßstab entwickelt. Die Konzentration an gelöstem Sauerstoff (DO) in Kulturen von Saccharomyces cerevisiae wurde mit chemischen optischen Sensoren (Typ PSt3) gemessen, die in die Schüttelkolben integriert waren. Der DO-Gehalt löste bei Bedarf eine Kohlenstoffzufuhr aus. Dieser Aufbau ermöglichte automatisierte Fed-Batch Kulturen in Schüttelkolben und erhöhte die Qualität der in diesem Maßstab erhaltenen Daten, ohne die Quantität der Ergebnisse zu beeinträchtigen. Verschiedene Stämme zeigten in der Schüttelkolbenkultur das gleiche Ranking wie im Bioreaktor-Maßstab. In einem zweiten Experiment wurde ein DO-Stat und kohlenstofflimitierter Prozess in dem Feedback-gesteuerten System getestet. Die Ergebnisse zeigten, dass der Prozess erfolgreich im Schüttelkolben-Maßstab durchgeführt werden konnte.
In der Bioprozessentwicklung für die Produktion von Pharmazeutika, Proteinen oder Nahrungsergänzungsmitteln werden Scale-Down Modelle eingesetzt, um beim Testen auf geeignete Zelllinien, Medienzusammensetzungen und Prozessbedingungen Zeit und Kosten zu sparen. Es ist jedoch oft schwierig, kritische Parameter für die Skalierung von Prozessen in kleinem Maßstab zu bestimmen. Schüttelkolben werden üblicherweise in der biotechnologischen Forschung und Produktion verwendet. Sie stellen eine kostengünstige Alternative zu teuren, größeren Bioreaktorsystemen dar und sind viel einfacher zu handhaben. Auf der anderen Seite gibt es kein etabliertes System zur Online-Überwachung und Kontrolle wichtiger Kulturparameter in diesem Maßstab. Um die Bioprozessentwicklung im Schüttelkolben-Maßstab zu verbessern, wäre eine zuverlässige Methode zur automatisierten Fütterung und die Eliminierung manueller Probenahmen erforderlich. In diesen Experimenten wurde ein Feedback-gesteuertes System getestet, das für Schüttelkolbenkulturen verwendet werden kann. Die Fütterung mit einer Kohlenstoffquelle wurde durch den DO-Gehalt in den Kulturen ausgelöst, der online mit der chemischen optischen Sensortechnologie von PreSens gemessen wurde. Die Sauerstoffsensoren wurden am Boden von Glas-Erlenmeyerkolben integriert und nicht-invasiv durch die transparente Kolbenwand ausgelesen. Das Sensorsignal wurde an das OXY-10 mini übertragen, ein 10-Kanal-Sauerstoffmessgerät, das gleichzeitige Online-Messungen in bis zu 10 Schüttelkolben ermöglicht. Mittels peristaltischer Pumpen wurde den Kulturen bei Bedarf automatisch die Glucoselösung zugesetzt. Wir führten Tests mit gepulstem Feed-on-Demand in Kulturen von S. cerevisiae durch, und verglichen die Ergebnisse mit Werten aus dem Bioreaktormaßstab (20 l). Außerdem wurde das System verwendet, um einen kohlenstofflimitierten Prozess zur Verbesserung der Biomasse und der Produktausbeute zu testen, wobei versucht wurde, DO bei etwa 20 % zu halten.
Material & Methoden
Die Experimente wurden in 500 ml Glasschüttelkolben mit 100 ml Arbeitsvolumen und einer Schüttelgeschwindigkeit von < 250 Upm bei 2,5 cm Schütteldurchmesser oder < 200 Upm bei 5,0 cm Schütteldurchmesser durchgeführt. Jeder Kolben hatte einen Sauerstoff Sensor Spot am Boden integriert und wurde auf den Coaster CFG gestellt. Der Coaster ist ein Zubehörteil, mit dem das Sensorsignal an das Sauerstoffmessgerät übertragen werden kann. Das OXY-10 mini wurde über RS232 an einen Lantronix S2E-Converter angeschlossen, der mit einen AdamBus A/D-Converter verbunden wurde. Der AdamBus A/D-Converter steuerte die peristaltischen Pumpen für die Fütterung. Ein PC mit Lucullus PIMS wurde verwendet, um Daten vom Lantronix S2E-Converter zu sammeln und den Prozess zu überwachen. Jeder Schüttelkolben wurde mit einer individuellen peristaltischen Pumpe mit Silikon- oder Pharmaschläuchen (12 - 16 Schlauchdurchmesser) verbunden, was einen Fluss von 0 bis 50 g/h erlaubte. Die Schläuche wurden an den Schüttelkolbenkappen befestigt (siehe Abb. 1). Die tatsächliche Förderrate wurde mittels einer Korrelation der Strömungsgeschwindigkeit gegenüber der Pumpgeschwindigkeit berechnet. Zuerst wurden Experimente mit vier verschiedenen Stämmen von S. cerevisiae, mit jeweils zwei Ansätzen, in 8 Schüttelkolben durchgeführt. Bei Bedarf wurde den Kulturen 500 g/l Glucoselösung, als Kohlenstoffquelle, mit Pulsen von 0,5 Stunden bei einer Zufuhrrate von 20 g/h zugegeben. Vorschubgeschwindigkeit und Impulsdauer sind Erfahrungswerte. Der Start der Fütterung wurde ausgelöst, wenn ΔDO/10 min > 10 % war. In einem zweiten Experiment wurde versucht, S. cerevisiae in einem kohlenstofflimitierten Prozess auf statischem Sauerstoff zu halten. Es wurde 150 g/l Glucoselösung verwendet, und der Fütterungsstart wurde erneut ausgelöst, wenn ΔDO/10 min > 10 % betrug. Ein einfacher 2-Schritt-Controller wurde verwendet, um DO bei einem Sollwert von 20 % mit 0,5 % Inkrement zu halten.
Ergebnisse
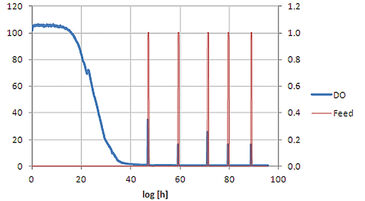
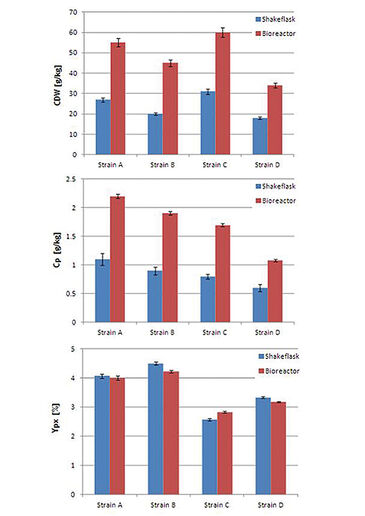
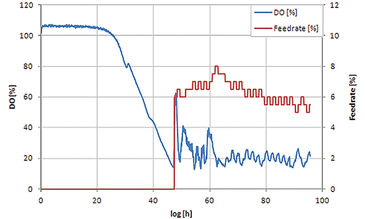
Das Feed-on-Demand-Experiment wurde 96 Stunden lang durchgeführt (Abb. 2). In der ersten Phase wurde die bereits vorhandene Glucose verbraucht und aufgrund des diauxischen Wachstums von S. cerevisiae teilweise in Ethanol umgewandelt. Das Wachstum der Zellen führt zu einer Abnahme des DO-Gehalts; nach etwa 22 Stunden (kleiner Peak im DO-Signal) war die Glukose erschöpft und das Wachstum setzte sich unter Ethanolverbrauch fort. Aufgrund der begrenzten Sauerstofftransferkapazität von Schüttelkolben erreicht der Sauerstoffgehalt bei etwa 40 Stunden Nullwerte. Als auch das Ethanol verbraucht war, war keine Kohlenstoffquelle mehr im Medium vorhanden, was zu einer verringerten Sauerstoffaufnahme durch die Zellen und daher zu einem Anstieg des Sauerstoffgehalts führte. Dieser Anstieg wurde als Auslöser für die Glucoseaddition verwendet. Sobald die zugesetzte Glucose und das produzierte Ethanol erneut verbraucht waren, wurde mit der nächsten Zugabe begonnen. Beim Vergleich des Trockengewichts und der Produktionsausbeute der vier S. cerevisiae-Stämme im Schüttelkolbenaufbau mit im Bioreaktormaßstab (20 l) erhaltenen Ergebnissen zeigte sich, dass die Schüttelkolbenkulturen eine geringere Ausbeute von Zelltrockengewicht und Produktkonzentration (Abb. 3) erreichten, was auf der höheren Sauerstofftransferkapazität von Bioreaktoren beruht. Nichtsdestoweniger zeigten alle Stämme das gleiche Ranking in beiden Kultivierungsmaßstäben, was es ermöglichte, Stämme mit speziellen Eigenschaften für spätere Scale-Up-Prozesse auszuwählen. Der Vergleich der relativen Produktionsparameter ergab eine gute Übereinstimmung der Schüttelkulturwerte mit denen im Bioreaktormaßstab (Abb. 3). In einem zweiten Experiment wurde das automatisierte Schüttelkolbensystem in kohlenstofflimitierter Kultivierung mit statischem DO getestet. Abbildung 4 zeigt, dass das automatisierte Fütterungssystem zur Durchführung einer DO-Stat-Kultivierung verwendet werden kann. Sobald die DO-Werte unter den Sollwert fielen, wurde die Fütterungsrate verringert und umgekehrt. Die gewählten Parameter (0,5 % Fütterungsraten-Inkrement, 1 h Schrittzeit) führten bereits zu einer sehr guten DO-Kontrolle. Eine weitere Feineinstellung mit definierten Prozessbedingungen kann zu einer noch geringeren Oszillation des DO-Signals führen.
Zusammenfassung
Das entwickelte Feed-on-Demand-System für die Schüttelkolbenkultivierung zeigte gute Ergebnisse und im Vergleich zu Werten aus dem Bioreaktor-Maßstab kann gefolgert werden, dass verschiedene Stämme im Schüttelkolben-Maßstab verglichen und ausgewählt werden können. Darüber hinaus waren Tests in diesem Setup extrem zeitsparend. Während nur 2 oder 3 Experimente im Bioreaktor-Maßstab durchgeführt werden können, ermöglicht dieses System die Durchführung von 8 - 10 Tests pro Woche. Selbst einen Lauf mit einem kohlenstofflimitierten Prozess führte das System mit unerwartet guten Ergebnissen aus. Die Möglichkeit, Sauerstoff online und in mehreren Schüttelkolben gleichzeitig mit dem PreSens OXY-10 mini zu messen, ist ein entscheidender Vorteil für Versuche in Scale-Down-Prozessen. Weitere Experimente mit dem SFR Shake Flask Reader, der die Sauerstoff- und pH-Messung in bis zu 9 Schüttelkolben ermöglicht, könnten dieses automatisierte und teilweise kontrollierbare System im Schüttelkolben-Maßstab verbessern. Die Weiterentwicklung des Setups ist bereits geplant.