Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Screening von Pilzmetaboliten in einem mikrofluidischen Bioreaktor
pH-Messungen in Pflanzenzellkulturen mit pH-1 SMA HP5
L. Schmidt-Speicher1, C. Metzger2, F. Kinn1, B. Bailer3, Dr R. Ahrens1
1Karlsruhe Institut für Technologie, Institut für Mikrostrukturtechnik, Eggenstein-Leopoldshafen, Germany
2Karlsruhe Institut für Technologie, Botanisches Institut, Karlsruhe, Germany
3Hochschule Biberach, Biberach, Germany
Als sessile Organismen können Pflanzen Stressfaktoren nicht einfach durch Standortwechsel umgehen. Um die Qualität und Quantität von abiotischen und biotischen Stressfaktoren zu bewerten, haben Pflanzen komplexe Signalwege entwickelt. Oftmals werden Moleküle, die zu potenziellen Krankheitserregern gehören, auf der Ebene der Plasmamembran der Pflanzen erkannt. Nach der Erkennung wird das Signal von der Außenseite der Zelle in die Zelle weitergeleitet und löst schließlich, wenn möglich, eine Abwehrreaktion aus [1]. Bei der Pathogen-getriggerten Immunität (PTI), einer basalen Abwehrreaktion, wird das Signal häufig mit Hilfe des sekundären Botenstoffs Ca2+ übertragen. Der Extrazellulärraum enthält eine relativ hohe Ca2+-Konzentration, insbesondere im Vergleich zur Konzentration im Zytoplasma der Zelle. Um auf die Anwesenheit des Erregers zu reagieren, werden Ca2+-Ionen in die Zelle transportiert, um mit Hilfe von Transkriptionsfaktoren das Verhalten der Zelle zu verändern [2]. Dieser Ca2+-Import erfolgt in Kombination mit dem Transport von H+ durch die Plasmamembran [3]. Der Transport von Protonen führt zu einer Verschiebung des extrazellulären pH-Werts, die leicht quantifizierbar ist. Die pH-Verschiebung ist ein häufig verwendetes Messinstrument, um zu beurteilen, ob Pflanzen eine PTI-Reaktion durchführen.
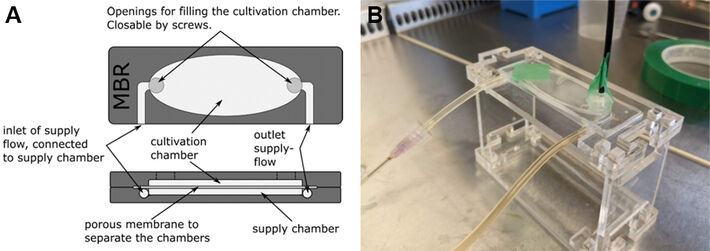
Um mehrere Pilzmetabolite in schneller Folge auf ihre Immunaktivität zu screenen, wird ein einfaches und zuverlässiges System zur Messung von pH-Änderungen im mikrofluidischen Bioreaktor (MBR) benötigt, der vom Institut für Mikrostrukturtechnik (IMT) des KIT in Zusammenarbeit mit dem Botanischen Institut des KIT entwickelt wurde. Dazu wurde eine herausziehbare, aber versiegelnde Verbindung vom PreSens pH-1 SMA HP5 zum entsprechenden Sensorspot SP-HP5 im MBR entworfen und sowohl mechanisch als auch in biologischen Experimenten untersucht. Der MBR ist ein Zweikammer-Bioreaktor, der für die Kultivierung von Pflanzenzellen verwendet wird (siehe Abb. 1A). Eine durchlässige Membran trennt die Kultivierungs- und die Nährstoffflusskammer. Er wurde erstmals von Tim Finkbeiner am IMT [4] konzipiert und weiterentwickelt. Über zwei Öffnungen an beiden Enden der ovalen Kammer können Zellen in die Kultivierungskammer eingebracht werden. Die Öffnungen sind mit M5-Gewinden versehen, um sie mit geeigneten Schrauben verschließen zu können. Die MBRs können über einen unidirektionalen Fluss mit weiteren MBRs verbunden werden. So werden die in der Kultivierungskammer verbleibenden Zellen kontinuierlich mit frischem Medium und Stoffwechselprodukten aus den vorangegangenen MBRs versorgt, während ihre eigenen Stoffwechselprodukte zu den nachfolgenden MBRs transportiert und Abfälle abgeführt werden. Das Grundprinzip besteht darin, durch die Kultivierung von Zellen einer Art pro MBR den interzellulären Kommunikationsweg zu zerlegen, um Informationen über die beteiligten Prozesse und Reaktionen zu gewinnen. Der pH-Wert wird mit dem pH-1 SMA HP5 quantifiziert, während Zellen der BY2-Linie von Nicotiana tabacum in der Kultivierungskammer der MBRs kultiviert werden. Dem Medium, das den Zellen zugeführt wird, können Substanzen zugesetzt werden, deren Immunaktivität bewertet werden soll. Sollte ein Anstieg des pH-Wertes zu beobachten sein, kann dies als erster Hinweis auf eine Immunaktivität der Substanz von Interesse interpretiert werden.
Material & Methoden
Verbindungsaufbau und mechanische Bewertung
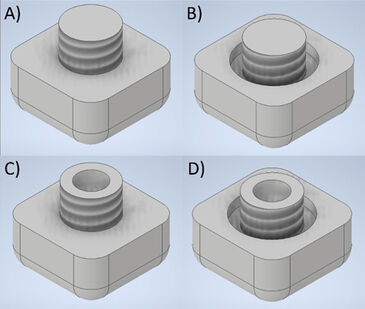
Wichtige Kriterien für die Verbindung sind eine dichte, aber abnehmbare Abdichtung der Wachstumskammer und eine einfache und intuitive Handhabung. Weiterhin wurde eine geringe Bauhöhe der Anschlüsse angestrebt, so dass das System für die Beobachtung unter dem Mikroskop geeignet bleibt. Entsprechend diesen Anforderungen wurden vier Steckerdesigns hergestellt. Die Steckverbinder wurden in einem MBR getestet und auf ihre Leistungsfähigkeit geprüft. Die vier Steckverbinder für die optische Faser (siehe Abb. 2) wurden aus Polycarbonat (PC) hergestellt, da dies das Gehäusematerial des MBR ist. Zwei Steckverbinder wurden mit einer Blindbohrung versehen, während die anderen beiden Steckverbinder durchbohrt und anschließend versiegelt wurden. Für die Abdichtung wurden eine PC-Folie, einfaches Klebeband und Polydimethylsiloxan (PDMS) getestet. Auf diese Weise sollte festgestellt werden, ob die Transparenz, die bei den blind gebohrten Steckverbindern durch die Kratzspuren des Bohrwerkzeugs beeinträchtigt war, die Genauigkeit der Messungen beeinflusste. Darüber hinaus wurde ein Steckverbinder jeder Art mit einer zusätzlichen Nut versehen, um einen zusätzlichen Dichtungsring als zweite Option für den Fall einer Leckage aufzunehmen. Zunächst wurde die Transparenz der hergestellten Verbindungsschrauben durch Messung und Vergleich der Transmission durch den Boden des Blindbohrlochs sowie der Dichtungsfolien mit einem Leitz Ergoplan Mikroskop in Kombination mit dem Red Tide USB650 Fiber Optic Spectrometer von OceanInsight geprüft. Zweitens wurden die hergestellten Verbindungsschrauben auf ihre Dichtungsfähigkeit getestet. Ein MBR wurde mit dem getesteten Verbinder verschlossen und an eine Spritzenpumpe (Harvard Apparatus PHD Ultra) angeschlossen. Dann wurde deionisiertes Wasser (DI-Wasser) mit einer konstanten Flussrate von 2 ml/min durch den MBR gepumpt. Der Test wurde 15 Minuten lang fortgesetzt, um sicherzustellen, dass die Verbindung vollständig dicht war und trocken blieb. Nach der Dichtheitsprüfung der Anschlüsse wurde der pH-1 SMA HP5 an einen MBR angeschlossen (Abb. 3 A). Ein pH Sensorspot (SP-HP5) wurde auf der dem Inneren des MBR zugewandten Seite des Steckers angebracht, und der Stecker wurde in die Öffnung des MBR geschraubt. Schließlich wurde die optische Faser in den entsprechenden Anschluss gesteckt und drei verschiedene pH-Pufferlösungen (pH 6,00, pH 7,413 und pH 8,00, Carl Roth) wurden nacheinander durch das System gepumpt, um die Messleistung des Sensor-Anschlusses zu bewerten. Die gemessenen Daten wurden mit Messungen des Puffers mit einem Mettler Toledo SevenCompact S220 als externem pH-Sensor verglichen.
Zelllinie und Kultivierungsaufbau
Für die Versuche zur BY2-Kultur wurde eine Zellsuspensionskultur von N. tabacum in Murashige- und Skoog-Medium (MS) kultiviert, das 4,3 g/l Murashige-Skoog-Salze, 30 g/l Saccharose, 200 mg/l KH2PO4, 100 mg/l Myo-Inositol, 1 mg/l Thiamin und 0,2 mg/l 2,4-Dichlorphenoxyessigsäure enthielt. Die Zellkultur wurde wöchentlich subkultiviert, indem 1,5 ml der sieben Tage alten Zellsuspension in 30 ml frisches MS in einem sterilen Erlenmeyerkolben überführt und im Dunkeln bei 26°C auf einem auf 150 U/min eingestellten Orbitalschüttler kultiviert wurde. Um die Zellen im MBR zu kultivieren, wurden 750 µl der 7 Tage alten Zellsuspension vorsichtig in die Kultivierungskammer des MBR pipettiert und mit Hilfe einer Peristaltikpumpe mit frischem MS-Medium versorgt (siehe Abb. 3 B). Der Fluss wurde in einer unidirektionalen Kreisströmung durch den Chip organisiert. Die Peristaltikpumpe pumpte 134 µl/min durch die Schläuche.

Messung der Chitosan-induzierten pH-Verschiebung
Es ist bekannt, dass Chitosan in Pflanzenzellen eine Immunreaktion mit einer entsprechenden Verschiebung des extrazellulären pH-Wertes hervorruft. In dieser Arbeit wurden die im MBR kultivierten BY2-Zellen mit 25 µg/ml Chitosan (Sigma Aldrich Chemie GmbH, Deutschland) und einer entsprechenden Lösungsmittelkontrolle von 0,0025 % Essigsäure behandelt. Zunächst wurde der Aufbau wie oben beschrieben in einer Cleanbench installiert, wobei Schläuche den MBR, die Pumpe und das MS-Mediumgefäß kreisförmig verbanden. Dann wurde das MS-Medium mit 134 µl/min durch das System gepumpt und kurz vor Erreichen des MBR zum ersten Mal gestoppt. 750 µl der 7 Tage alten Zellsuspension wurden in die Zellkammer überführt. Die Pumpe wurde gestartet, und der Chip wurde aufrecht gedreht, während er mit MS gefüllt wurde, um das Austreiben der verbleibenden Lufteinschlüsse zu erleichtern. Sobald das MS-Medium aus dem Auslass des Chips auszutreten begann, wurde der Chip in seiner endgültigen horizontalen Position in das Gerüst eingebaut. Vor Beginn der pH-Messung wurde der Sensor im Inneren des Chips 90 Minuten lang äquilibriert. Anschließend wurde der pH-Wert 30 Minuten lang gemessen, um den Basis-pH-Wert zu berechnen. Dann wurde das Chitosan oder die Essigsäure zugegeben, und der jeweilige Zeitpunkt wurde als 0:00 definiert. Nach der Behandlung wurde der pH-Wert zwei Stunden lang kontinuierlich alle 30 Sekunden gemessen. Für jede Behandlung wurde ein biologisches Triplikat erstellt.
Ergebnisse & Diskussion
Mechanische Ergebnisse
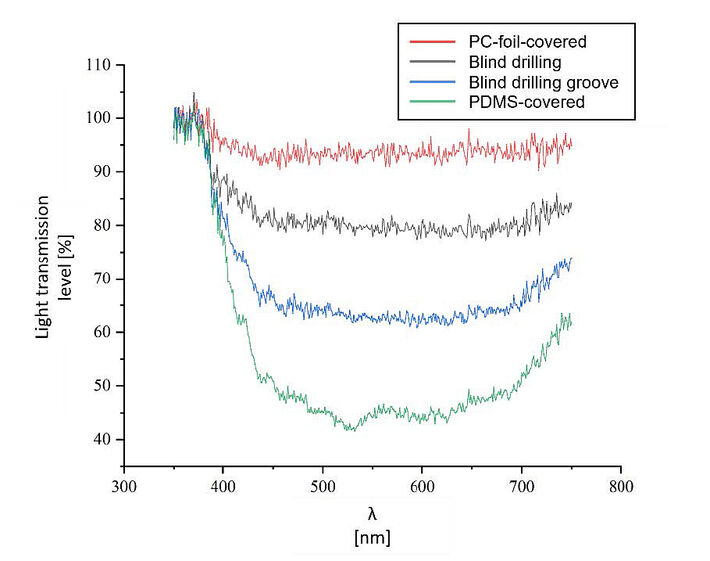
Die beiden Steckerkonstruktionen mit der durchgebohrten Öffnung für den Lichtwellenleiter wurden mit einer PC-Folie, PDMS und 3M-Polyesterband 851 ("grünes Band") abgedeckt, um eine dichte Grenze zwischen der Kulturkammer und dem Lichtwellenleiter außerhalb des MBR zu schaffen. Die PC-Folie konnte in unseren Versuchen nicht ausreichend verklebt werden, aber das 3M-Polyesterband 851 dichtete den Anschlussstecker ausreichend ab. Dieser mit Klebeband abgedichtete Stecker konnte jedoch aufgrund der grünen Farbe und der geringen Lichtdurchlässigkeit des Klebebandes nicht für pH-Messungen verwendet werden. Auch das mit PDMS versiegelte Bohrloch wurde dicht verschlossen. Die blind gebohrten Anschlüsse dichteten beide den MBR ausreichend ab. Es gab keinen erkennbaren Vorteil für die Abdichtung des Systems durch eine zusätzliche Nut und einen zusätzlichen Dichtungsring im Vergleich zu dem Verbinder ohne diese. Der einfache, blind gebohrte Verbinder dichtete den MBR ausreichend ab. Hinsichtlich der Transparenz zeigte der PDMS-versiegelte Verbinder die niedrigste Transmissionsrate, während der mit PC-Folie versiegelte Verbinder etwa 95 % des Lichts durchließ (siehe Abb. 4). Die niedrige Transmission des PDMS könnte jedoch auf Probleme beim Messaufbau zurückzuführen sein.
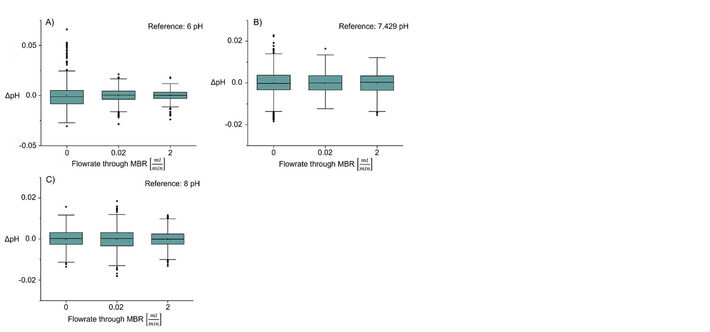
Als nächstes wurde das Stecker-Sensor-Setup hinsichtlich der Genauigkeit der pH-Messungen getestet. Da die pH-Pufferwerte der Hersteller im Vergleich zum S220-Sensor genau waren, wurden die Messungen mit den angegebenen Werten als Referenz verglichen. Die pH-Werte des jeweiligen Puffers im MBR wurden dreimal bei der jeweiligen Durchflussrate für zehn Minuten (bei Durchflussrate 0 ml/min und 2 ml/min) und für 45 Minuten (bei Durchflussrate 0,2 ml/min) gemessen. Die Boxplots wurden für die kombinierte Datenbasis der drei Messungen erstellt (Abb. 5). Es wurde die absolute Abweichung vom vorgegebenen Pufferwert bestimmt. Für alle drei Bedingungen und alle drei pH-Werte ist der Interquartilsbereich klein und liegt zwischen 0,014 pH und 0,005 pH. Median und Mittelwert sind - abgesehen von der pH-Auswertung im 6-pH-Puffer ohne Strömungsumlauf - nahezu gleich. Es kann also von einer symmetrischen Verteilung der Messwerte ausgegangen werden.
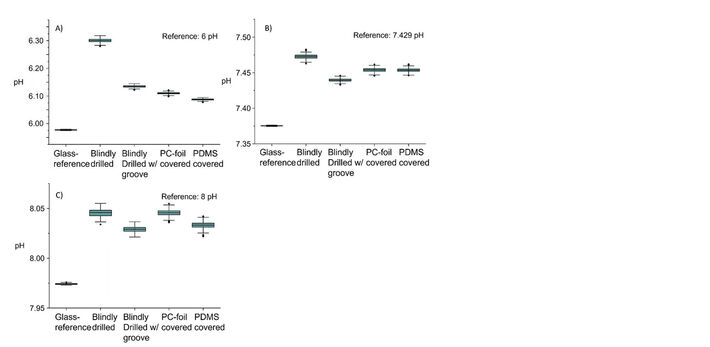
Vergleicht man jedoch die verschiedenen Anschlüsse mit einer Messung in einem Glasbecher als Referenzsystem, so zeigen die Messungen im MBR eine deutlich höhere Messung desselben Puffers als die Messung im Becherglas (Abb. 6). Dies könnte darauf zurückzuführen sein, dass der Sensor für Glasreaktoren und nicht für die Messung durch Polymere ausgelegt ist. Da sich aus der Verwendung unterschiedlicher Anschlüsse kein Muster ableiten lässt, das mit den unterschiedlichen gemessenen Lichttransmissionen übereinstimmen würde, ist davon auszugehen, dass die unterschiedlichen Transparenzen der verschiedenen Anschlüsse nicht die Hauptursache für den Offset in den Messungen waren.
Biologische Experimente - Chitosan-induzierte pH-Verschiebung
Der mikrofluidische Aufbau wurde wie zuvor beschrieben unter einem sauberen Tisch mit einer Umgebungstemperatur von 25°C installiert. Nach einer 90-minütigen Äquilibrierung des Sensorspots wurde der pH-Wert 30 Minuten lang gemessen, bevor die Substance of Interest (SoI) hinzugefügt wurde. Anschließend wurde der pH-Wert zwei Stunden lang kontinuierlich beobachtet, wobei alle 30 Sekunden ein Messpunkt gesetzt wurde.
Der Mittelwert der pH-Werte, die 30 Minuten vor der Zugabe der SoI gemessen wurden, wurde als Basis-pH-Wert betrachtet und zur Berechnung des ΔpH jedes Zeitpunkts (t) verwendet:
ΔpH(Sol) = pH(t) - pHBasiswert
Um festzustellen, ob Chitosan eine pH-Verschiebung hervorruft, musste die durch das Chitosan-Lösungsmittel hervorgerufene pH-Verschiebung von dem bei der Chitosan-Behandlung beobachteten pH-Wert abgezogen werden:
ΔΔpHchitosan = ΔpHchitosan - ΔpHLösungsmittel CTRL
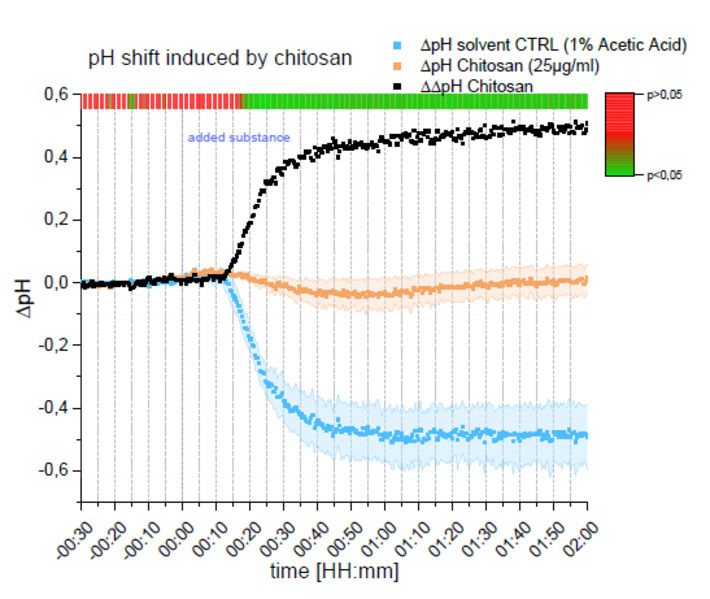
Die sich daraus ergebenden Daten von ΔΔpHchitosan, ΔpHchitosan und ΔpHsolvent Kontrolle (CTRL) sind in Abbildung 7 dargestellt. Alle Behandlungen wurden in dreifacher Ausführung durchgeführt und der Standardfehler von ΔpHchitosan und ΔpHLösungsmittel CTRL wurde notiert. Zur Berechnung von ΔΔpHchitosan wurden die Mittelwerte von ΔpHchitosan und ΔpHLösungsmittel CTRL voneinander abgezogen. Die Signifikanz der Unterschiede zwischen ΔpHchitosan und ΔpHLösungsmittel CTRL zu verschiedenen Zeitpunkten wurde mit dem T-Test mit einem Signifikanzniveau von p<0,05 berechnet und ist als Heatmap oben in Abbildung 7 dargestellt. Die Lösungsmittel CTRL zeigte einen starken Abfall des pH-Wertes, der etwa 15 Minuten nach der Behandlung einsetzte und anschließend auf dem gesenkten Niveau blieb. Durch die Chitosan-Behandlung sank der pH-Wert leicht ab und stabilisierte sich wieder auf dem Ausgangswert. In Anbetracht des durch das Lösungsmittel verursachten Absinkens des pH-Wertes deutet das ΔΔpHchitosan darauf hin, dass Chitosan einen erheblichen Anstieg des extrazellulären pH-Wertes bewirken kann, der mit dem pH-1 SMA HP5-System messbar ist.
Conclusion
Aus den Ergebnissen unserer Experimente und den verschiedenen Designs schlossen wir, dass die Lichtdurchlässigkeit durch die verschiedenen Steckerdesigns die Messung nicht signifikant zu beeinflussen schien. Es schien jedoch, dass die Polymer-Steckverbinder eine Verschiebung des gemessenen pH-Wertes im Vergleich zu einer Referenzmessung durch ein Glasbecherglas zeigten. Da in den Sensorrichtlinien Glas als geeignetes Reaktormaterial angegeben ist, könnte es eine spezielle Kalibrierung geben, um die Lichtbrechung in Glas zu bewältigen, die bei Verwendung eines Polymers zu einer Verschiebung der Messwerte führt. Wenn diese Verschiebung verifiziert werden kann - vielleicht durch weitere und anders aufgebaute Tests - und berücksichtigt würde, wäre das pH-1 SMA HP5 mit den entsprechenden Spots geeignet, um pH-Werte in unserem MBR zu messen.
In einem früheren Experiment haben wir bestätigt, dass 25 µg/ml Chitosan einen Anstieg des extrazellulären pH-Werts in BY2-Zellen verursacht, indem wir den pH-Wert mit einem Tisch-pH-Meter mit Elektrode gemessen haben. Mit der gleichen Behandlung soll in dieser Arbeit bewiesen werden, dass eine Kombination aus dem MBR und dem pH-1 SMA HP5 System verwendet werden kann, um den mit der Immunreaktion verbundenen Anstieg des extrazellulären pH-Wertes zu beobachten. Nach Beginn der Behandlung war ein signifikanter Anstieg des pH-Wertes nach 15 Minuten zu beobachten (siehe Abb. 7). Diese Verzögerung erklärt sich durch die Zeit, die das behandelte MS benötigt, um in den MBR gepumpt zu werden. Die beobachtete pH-Verschiebung deutet darauf hin, dass die Methode zum Screening auf die Immunoaktivität von Substanzen auf Pflanzenzellen verwendet werden kann. Durch die Verwendung mehrerer Kanäle und Sensorspots wird es möglich sein, eine Screening-Methode mit hohem Durchsatz zu etablieren. Darüber hinaus haben wir die Entwicklung von Nährstoffgradienten in der Kultivierungskammer des MBR aufgrund der ovalen Form der Kammer untersucht. Im Hinblick auf diese Auswertung wäre die Analyse des pH-Wertes in einem größeren Bereich, z.B. mit dem VisiSens System, interessant. Allerdings müssten die Sensorfolien perforiert werden, damit der Nährstoffstrom in die Kulturkammer gelangt, und es müsste ein Montageverfahren für die Sensorfolien etabliert werden.
Danksagung
Wir danken der Firma PreSens herzlich für die Möglichkeit, ihren optischen Sensoraufbau für pH-Messungen zu testen.
Referenzen
[1] Jones, Jonathan D. G.; Dangl, Jeffery L. (2006): The plant immune system. In: Nature 444 (7117), S. 323–329. DOI: 10.1038/nature05286.
[2] Lecourieux, David; Ranjeva, Raoul; Pugin, Alain (2006): Calcium in plant defence-signalling pathways. In: The New phytologist 171 (2), S. 249–269. DOI: 10.1111/j.1469-8137.2006.01777.x.
[3] Demidchik, Vadim; Shabala, Sergey; Isayenkov, Stanislav; Cuin, Tracey A.; Pottosin, Igor (2018): Calcium transport across plant membranes: mechanisms and functions. In: The New phytologist 220 (1), S. 49–69. DOI: 10.1111/nph.15266.
[4] Finkbeiner, Tim (2019): Entwicklung eines mikrofluidischen Bioreaktors für die Kultivierung von Pflanzenzellen. Dissertation. Karlsruher Institut für Technologie, Karlsruhe. Institut für Mikrostrukturtechnik.