Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Überwachung der Sauerstoffversorgung in mikrofluidischen Zellkulturen mit 2D-Sensorfolien als Wachstumssubstrat (Vollversion)
Sauerstoff-Imaging mit VisiSens™
C. Schmittlein1, R. J. Meier2, L. Sauer1, G. Liebsch2, J. Wegener1,3
1Institut für Analytische Chemie, Chemo- und Biosensoren, Universität Regensburg, Regensburg, Deutschland
2PreSens Precision Sensing GmbH, Regensburg, Deutschland
3Fraunhofer-Einrichtung für Mikrosysteme und Festkörper-Technologien EMFT, Regensburg, Deutschland
Whitepaper Zusammenfassung
Zellen reagieren sehr unterschiedlich auf die Sauerstoffversorgung in ihrer Mikroumgebung. Die Sauerstoffverfügbarkeit für Zellen in Mikrofluidiken ist aufgrund der geringen eingesetzten Volumina stark eingeschränkt. Hier zeigen wir, wie die Sauerstoffverfügbarkeit und der Sauerstoffverbrauch während der Kultivierung in Mikrofluidiken markierungsfrei mithilfe des VisiSens™ Sauerstoff-Imagingsystems von PreSens überwacht werden können.
Unsere Untersuchungen zeigen, dass Sauerstoff mit Hilfe von Lumineszenzsensoren, die im Wachstumssubstrat und als Bodenplatte integriert sind, direkt im Inneren der Mikrofluidikkanäle gemessen werden kann. Diese Label-freie Messtechnik ermöglicht die Erfassung in sehr kleinen Volumina ohne dabei den Analyten während der Messung zu verbrauchen. Planare Sensorfolien erlauben ein quantitatives 2-dimensionales Auslesen mit der Option, lokale Sauerstoffkonzentrationen und -gradienten in jedem Sichtfeld zu analysieren, verschiedene Regionen zu vergleichen oder mehrere Experimente in parallelen Kanälen gleichzeitig zu überwachen.
Wir stellten für konfluente MDCK II-Zellkultur unter statischen Bedingungen fest, dass der Sauerstoff in den Mikrofluidik-Chips bereits nach 2,5 Stunden nach Einführen frischen Mediums aufgebraucht war. Diese Tatsache wurde verwendet, um schnelle Respirationstests durchzuführen, mit denen die Wirkung verschiedener Arzneimittel auf die Zellatmung in einem intermittierenden Flussexperiment untersucht werden konnte.
Hinsichtlich der Oxygenierung von mikrofluidischen Zellkulturen muss das Gleichgewicht zwischen Sauerstoffzufluss und -verbrauch durch Atmung genau überwacht und angepasst werden, da die meisten Materialien, die zur Herstellung von mikrofluidischen Strukturen verwendet werden, nur eine sehr begrenzte Sauerstoffpermeabilität aufweisen. Die Daten in dieser Studie zeigen, wie schnell die Zellmikroumgebung unter statischen Kulturbedingungen hypoxisch wird, was einen großen Einfluss auf die Lebensfähigkeit und die Proliferation der untersuchten Zellen hat. Die Kontrolle des O2-Gehalts und gut eingestellte Perfusion ist in diesen Systemen unabdingbar, um den Phänotypen physoxischer Zellen und relevanten Ergebnisse zellbasierter Assays so nahe wie möglich zu kommen.
Seit dem Aufkommen von Tiergewebe- und Zellkultur im Jahr 1912 haben sich die Schalen und später Flaschen, die zur in vitro Zucht und dem Erhalt von Zellen verwendet wurden, in ihrer Hauptgeometrie nicht wesentlich verändert. Nichtsdestoweniger wurde die in vitro Kultur von tierischen und menschlichen Zellen zu einer Erfolgsgeschichte mit Anwendungen in den gesamten Life Sciences. Die Einführung von mikrofluidischen Vorrichtungen hat die Situation verändert und diesem Bereich völlig neue Konzepte und Möglichkeiten erschlossen, wie Zellen in Perfusion zu kultivieren, mit geringer Zellzahl zu arbeiten, Zellen einer genau definierten und variablen Scherspannung auszusetzten oder die direkte Kopplung mit Downstream-Analysesystemen, die in der Lage sind die Inkubationsflüssigkeit zu analysieren [1]. Mikrofluidische Vorrichtungen haben sich als vielseitige Plattformen etabliert, um verschiedene Zellkulturbedingungen oder Mikroumgebungen in 2D- und 3D-Gewebemodellen nachzuahmen. In letzter Zeit werden sie in so innovativen Bereichen wie der Analyse und Identifizierung von zirkulierenden Tumorzellen [2], der Stammzellenforschung und µTAS-Geräten für die Zellanalyse eingesetzt. Mikrofluidik ist die Grundlage für Organ-on-a-Chip oder sogar Body-on-a-Chip Ansätze, da sie es erlaubt, die entsprechenden Gewebe in Reihe oder parallel zueinander mit einer fluidischen Verbindung, ähnlich der Situation im Körper, zu platzieren. Aufgrund ihrer kompakten Architektur bieten mikrofluidische Chips viele Vorteile gegenüber der Standard-Well-Platten-Kultur, z. B. geringe Flüssigkeits- oder Probenvolumina, gute Prozesskontrolle sowie schnelle Analyse- und Reaktionszeiten. Die Mikrofluidik wird als eine "enabling technology" zur massiven Parallelisierung von zellbasierten Assays angesehen, die diese Geräte für die Wirkstoffforschung im Allgemeinen und die Analyse mit hohem Durchsatz im Besonderen an Bedeutung gewinnen lässt.
Die Sauerstoffverfügbarkeit in der zellulären Mikroumgebung beeinflusst stark den zellulären Phänotyp und Metabolismus. Zum Beispiel ist bekannt, dass regernative Stamm- und Vorläuferzellen in einem proliferativen Zustand bleiben, wenn sie in ihrer Sauerstoffnische gehalten werden [3], während erhöhte Sauerstoffkonzentrationen toxisch wirken und verringerte Sauerstoffkonzentrationen Zellsignalwege zur Differenzierung oder Apoptose aktivieren können. Das Gleichgewicht von Sauerstoffzustrom und Sauerstoffverbrauch bestimmt den Zustand der Mikroumgebung. Zellen in normalem Gewebe haben in Bezug auf Sauerstoff ihre spezifische Mikroumgebung die als Physoxie bezeichnet wird. Sie variiert von Kompartiment zu Kompartiment des Körpers und reicht von etwa 13 % (v/v) O2 in den Lungenalveolen bis zu fast 0 % (v/v) O2 im Knochen. Trotz ihrer unbestreitbaren Bedeutung, ist die Oxygenierung der Mikroumgebung ein weitgehend übersehener Aspekt der meisten in vitro Systeme und wird nur von Experten auf diesem Gebiet berücksichtig. Das geringe Volumen in mikrofluidischen Chips und die potentiell geringe Verfügbarkeit von gelöstem Sauerstoff macht eine präzise Sauerstoffüberwachung noch bedeutsamer. Aber selbst unter den üblicherweise angewandten Zellkulturbedingungen in Standardbehältern und Inkubatoren besteht eine erhebliche Diskrepanz zwischen der Oxygenierung in einem Zellkulturinkubator und der physiologischen Situation. Die meisten Zellkulturen werden immer noch mit einem Sauerstoffgehalt von ca. 19,9 % (v/v) O2 in der Inkubationsatmosphäre durchgeführt. Dieser Gehalt resultiert aus der Verwendung von 95 % (v/v) Umgebungsluft (ca. 21 % (v/v) O2) und 5 % (v/v) CO2, das üblicherweise eingesetzt wird um den pH-Wert des Mediums auszugleichen. Diese Bedingungen werden als Normoxie bezeichnet, darunterliegende Sauerstoffniveaus beschreibt man als Hypoxie. Letzteres ist irreführend, da der Sauerstoffgehalt im menschlichen Körper (Physoxie, siehe oben) niedriger ist als in normalen Zellkulturinkubatoren, und damit eher hypoxisch als normoxisch.
Sauerstoff in Mikrofluidiken
Betrachtet man das Gleichgewicht von Sauerstoffeinstrom und -verbrauch ist der Einstrom in mikrofluidischen Vorrichtungen der kritischste Parameter, und wird durch das mittlere Volumen, die Probengröße und die Perfusionsrate gesteuert. Alle drei Faktoren sind experimentell kontrollierbar, während der Sauerstoffverbrauch der zu untersuchenden biologischen Organismen das nicht ist [4]. Ein detailliertes Verständnis der Sauerstoffspannung in mikrofluidischen Vorrichtungen ist essentiell, um die in vitro Bedingungen in Zellkulturen der realen Physoxie anzunähern und die Basis für reproduzierbarere und standardisierte Ergebnisse mit maximaler physiologischer Relevanz zu schaffen.
Der "Goldstandard" zur Messung von Sauerstoff ist die Clark-Elektrode mit einem amperometrischen Ausleseverfahren. Eine Clark-Elektrode erzeugt einen direkten Kontakt zwischen der Probe und der äußeren Umgebung, wodurch das Risiko einer Kontamination erhöht wird. Gravierender jedoch ist, dass das elektrochemische Ausleseverfahren während der Messung Sauerstoff verbraucht, was bei der Untersuchung sehr kleiner Probenvolumina erhebliche Auswirkungen hat. Durch die Verwendung optischer Sauerstoffsensoren, lässt sich dieser Nachteil umgehen. Diese beruhen auf dem Prinzip der dynamischen Löschung von Lumineszenzsonden. Sie sind klein, können in verschiedenen Formaten hergestellt werden und die Signale werden in Form sichtbaren Lichts aufgezeichnet, so dass die Datenerfassung von außen, durch die transparenten Wände der mikrofluidischen Chips, leicht zugänglich ist. Lumineszenzsignale können in geschlossenen Kulturgefäßen ohne irgendeine mechanische Verbindung ausgelesen, und Störungen in der Probe somit minimiert werden. Lumineszenzsensorfarbstoffe können als freie Moleküle angewendet, in kleine Sensorpartikel eingebaut oder als planare Sensoren in ein Matrixmaterial eingebettet werden. Alle diese Formate haben individuelle Vorteile in Bezug auf Benutzerfreundlichkeit, Anwendbarkeit, Biokompatibilität und analytische Leistung. Während molekulare Sensoren oder Sensorpartikel in mikrofluidischen Vorrichtungen leicht anzuwenden sind, indem sie zur Perfusionsflüssigkeit hinzugefügt werden, haben Sie dennoch einige Tücken und Nachteile. Molekulare Indikatorfarbstoffe als solche - oder nach der Integration in Nanopartikel - setzen zytotoxischen Singulett-Sauerstoff frei, der während der Messung in situ erzeugt wird und sich nachteilig auf die Zellkulturen auswirken und das Experiment beeinflussen kann. Darüber hinaus sind Farbstoffe und Nanosensoren potentiell anfällig für starkes Photobleichen, was ihre Lebensdauer als funktionale Sensoren einschränkt. Der direkte Kontakt zwischen Sonde und Zelle wird oft ignoriert, ist aber zugleich Grund für zunehmende Bedenken, da sich Moleküle und Partikel in spezifischen Organellen oder zellulären Strukturen ansammeln können, die die Zellphysiologie und das analytische Auslesen beeinflussen können. Als Konsequenz können die untersuchten Zellen danach nicht für weitere Experimente verwendet werden, da sie mit der Sauerstoffsonde kontaminiert sind. Die Verwendung von planaren Sensoren mit immobilisierten Indikatoren überwindet all diese Nachteile, wenn die Zellen direkt auf der Oberfläche des Sensors wachsen. Unter diesen Bedingungen liegt der Abstand zwischen Zellmembran und Sensor in einer Größenordnung von nur 20 bis 200 nm. Die Farbstoffe sind in einem biokompatiblen Matrixmaterial immobilisiert, das verhindert, dass Singulett-Sauerstoff mit der Probe in Kontakt kommt. Obwohl Lumineszenzsensoren für die Messung verwendet werden, bleiben die Zellen frei von jeglichen Markern und können danach wiederverwendet werden. Planare Sensoren sind so konzipiert, dass sie kein Austreten des Sensorfarbstoffes zulassen, wodurch sie biokompatibel sind, und die geschützte Umgebung innerhalb der Matrix sorgt gleichzeitig für eine deutlich verbesserte Photostabilität.
Planare Optoden für Sauerstoff können zur Inline-Überwachung verwendet werden, wenn sie in Durchflusszellen integriert mit dem Ein- bzw. Auslass einer mikrofluidischen Vorrichtung verbunden sind. Alternativ werden die Sensoren als Sensorspots innerhalb des Kanals oder in den Vorratsbehältern angebracht, um den Sauerstoff darin zu überwachen. Für höchste räumliche Auflösung werden planare O2 Sensoren als Bodenplatte mikrofluidischer Kanalstrukturen verwendet, so dass sie gleichzeitig als Sensor und als Wachstumssubstrat für die zu untersuchenden Zellen dienen. In Kombination mit einer geeigneten Kamera kann mit diesem Aufbau über die gesamte fluidische Struktur hinweg in 2D ausgelesen werden. Diese 2D-Anzeige ermöglicht die Visualisierung von Gradienten sowie die Untersuchung verschiedener relevanter Bereiche in einem Experiment. In dieser Studie präsentieren wir ein 2D-Auslesesystem, genannt VisiSens™, zusammen mit planaren optischen Sauerstoffsensorfolien, die in mikrofluidische Kanäle integriert sind, um die Oxygenierung in mikrofluidischen Zellkulturen zu untersuchen. Aufgrund (i) des geringen Abstandes zwischen Membran und Sensoroberfläche, der durch Diffusion überbrückt werden muss, und (ii) der hohen O2-Permeabilität der Zellmembran spiegelt der ausgelesene Wert den Sauerstoffgehalt des Zytoplasmas in guter Näherung wider.
Material & Methoden
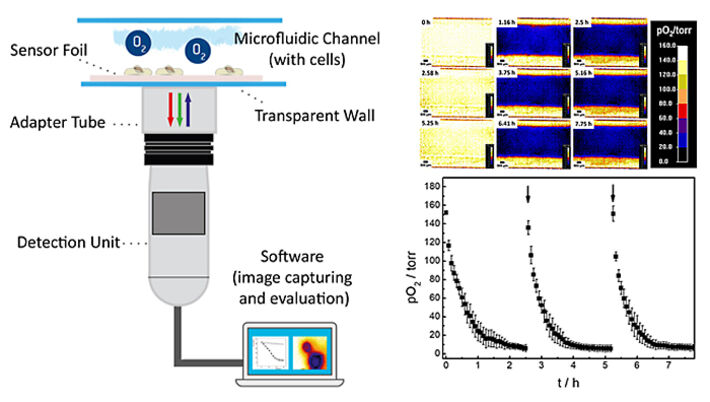
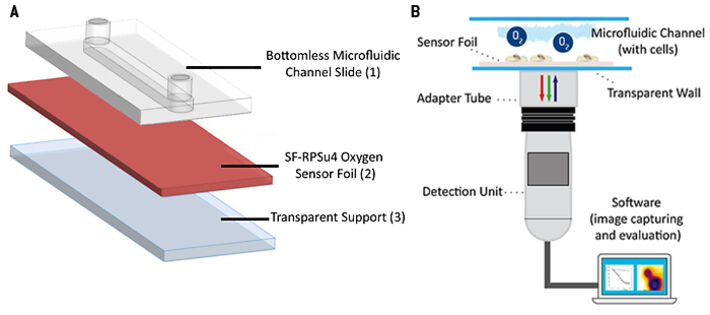
Die sauerstoffempfindliche planare Sensorfolie vom Typ SF-RPSu4 (PreSens, Deutschland) wurde mit Silikonkleber auf einem Objektträger befestigt. Der Objektträger bietet eine harte, starre und optisch transparente Auflage. Eine Schutzschicht, die auf den kommerziell erhältlichen Sensorfolien aufgebracht ist, wurde mechanisch von der empfindlichen Seite der Folie entfernt, um die Zelladhäsion zu verbessern und den Abstand zwischen Zellen und Indikatorfarbstoffen zu verringern. Eine selbstklebende mikrofluidische Vorrichtung ohne Bodenplatte (sticky-Slide I, 0,4 Luer; ibidi, Deutschland) wurde auf die Sensorfolie geklebt, und so der endgültige mikrofluidische Zellkulturbehälter mit integriertem, planarem O2 Sensor geschaffen. Der selbstklebende Mikrokanal hat eine Höhe von 450 µm, ein Kanalvolumen von 113 µl und eine Wachstumsfläche von 2,5 cm2. In einem weiteren Experiment nutzten wir zum Vergleich ein offenes Kanalsystem ohne Abdeckung. Dafür wurde eine offene PDMS-Kultivierungskammer mit derselben Wachstumsfläche von von 2,5 cm2 und 1 ml Volumen auf die Sensorfolie geklebt. Die Kammer wurde im Inkubator mit einem Deckel zugedeckt um ein Verdunsten des Mediums zu verhindern. Das Auslesen des planaren Sensors erfolgte mit dem Sauerstoffbildgebungssystem VisiSens A1 (PreSens, Deutschland). Das Auslesegerät ist ein über USB betriebener CMOS-Kameradetektor mit eingebauten Anregungs-LEDs und optischen Filtern. Die Sensorfolie wird mit blauem Licht angeregt und liefert rote und grüne Fluoreszenzemissionen. Die Lumineszenz der rot emittierenden Sonde ist empfindlich gegenüber der lokalen Sauerstoffkonzentration, während die grün emittierende Sonde gegenüber Sauerstoff unempfindlich ist und als interne Referenz dient, um Sonden-unabhängige Einflüsse auf die Emissionsintensität, wie z. B. Schwankungen der Intensität des einfallenden Lichts zu berücksichtigen. Das Verhältnis von roten und grünen Signalen liefert eine sauerstoffabhängige, ratiometrische Antwort in jedem Pixel innerhalb des Sichtfeldes. Eine Zweipunkt-Kalibrierung des Sensors wurde unter Verwendung von Zellkulturmedien mit 0 % (v/v) O2 (Medium ergänzt mit 10 g/l Na2SO3 zur Erzeugung einer sauerstofffreien Lösung) und 100 % Luftsättigung durchgeführt. Die automatische Zeitreihenerfassung und Auswertung der Sauerstoffbilder erfolgte mit der VisiSens AnalytiCal 1 Software (PreSens, Deutschland). Der vollständige Aufbau ist in Abbildung 2 skizziert.
MDCK II Zellen wurden unter statischen Bedingungen gemäß den Empfehlungen des Herstellers bis zur Konfluenz im endgültigen Mikrofluidikchip gezüchtet, beginnend mit einer Zelldichte von 1,0 x 105 Zellen cm-2. Das reguläre Wachstumsmedium wurde zu Beginn des Experiments durch serumfreies L-15 Medium, dem internen Laborstandard für Testpuffer, ersetzt. 2D-Sauerstoffaufzeichnungen der Zellmikroumgebung unter statischen Bedingungen wurden 24 Std. nach dem Aussäen begonnen, wobei alle 5 Min. eine Messung gemacht wurde. Das Medium wurde in regelmäßigen Zeitabständen nach Beginn der Sauerstoffmessung manuell ausgetauscht, indem 1 ml frisches L-15 Medium langsam durch den Kanal gespült wurde.
Ergebnisse
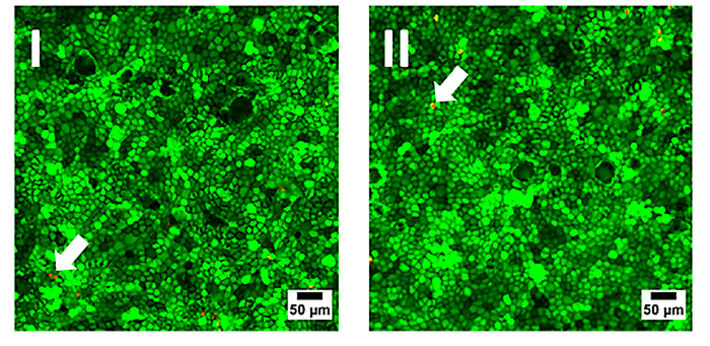
Zunächst wurde die Biokompatibilität der Sensorfolie untersucht, indem MDCK II-Zellen in ähnlicher Konzentration in reguläre Petrischalen (Referenz) aus für Zellkultur behandeltem Polystyrol und in Petrischalen mit einer auf den Boden der Schale geklebten Sauerstoffsensorfolie ausgesät wurden. Die Zellen wurden bis zur Konfluenz gezüchtet und die Lebensfähigkeit der Zellen auf den verschiedenen Substraten durch eine etablierte Lebend-tot-Färbung dokumentiert (Abb. 3). Dieses auf Fluoreszenz basierende Assay enthält zwei verschiedene Sonden: Calcein-AM und Ethidium-Homodimer. Ersteres färbt das Zytoplasma lebender Zellen hellgrün, während letzteres den Kern toter Zellen ,aufgrund der Interkalation des Farbstoffs in die DNA, durch rote Fluoreszenzemission markiert. Beide Proben zeigen ähnliche Ergebnisse mit nur sehr geringen Mengen an rot emittierenden toten Zellen in der Monolayer (Pfeile in Abb. 3). Die Aufnahmen sind austauschbar und es gibt keine Hinweise auf das Vorhandensein der Sensorfolie. Somit ist die Biokompatibilität der O2 Sensorfolien bestätigt und sie können als Ersatz für reguläre Zellkulturkunststoffe verwendet werden.
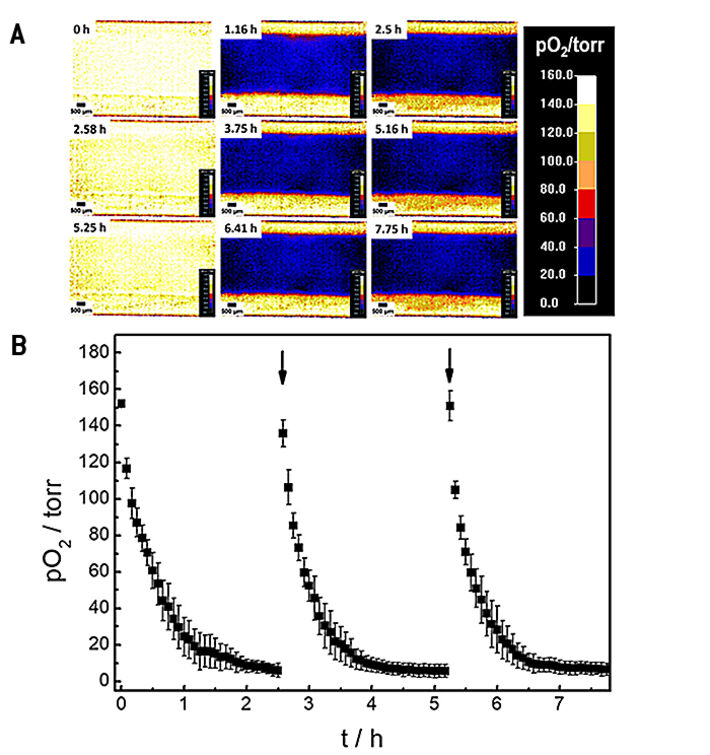
Die Oxygenierung innerhalb des mikrofluidischen Kanals und damit die Mikroumgebung der zellen wurde in einem Zeitreihenexperiment mit intermittierendem Austausch des Testpuffers untersucht. Änderungen der räumlichen 2D-Sauerstoffverteilung über die Zeit sind in Abbildung 4A als Falschfarbenbilder dargestellt. Die Pseudofarben kodieren die jeweiligen Sauerstoffpegel in jedem Pixel unterhalb der Zellschicht. Für die 2D-Sauerstoffaufzeichnungen wurde das verstellbare Sichtfeld des VisiSens A1 Systems so angepasst, dass die gesamte Kanalbreite abgedeckt war. Ein vergrößertes Sichtfeld führt zu einer Verringerung der Bildauflösung und umgekehrt. Die Zeitreihen von Bildern zeigen einen lateral homogenen, schnellen Abfall des Sauerstoffgehalts innerhalb einer Stunde. Dieser ist das Resultat der Zellatmung in einem nicht durchströmten System aus Materialien (Kanal, Bodenplatte) mit geringer Sauerstoffpermeabilität. Der intermittierende Austausch des Zellkulturmediums bei 0 Std., 2,58 Std. und 5,25 Std. führt zu einer wiederholten, vollständigen und homogenen Reoxygenierung des Kanals.
Durch Auswahl einer "Region of Interest" (ROI) können die zeitabhängigen Änderungen der Sauerstoffwerte quantitativ verfolgt werden. Drei aufeinanderfolgende Sauerstoffprofile von MDCK II-Zellen, die innerhalb des Mikrokanals mit intermittierender Strömung kultiviert wurden, aufgezeichnet in drei einzelnen Messungen, sind in 4B gezeigt. Nach Zugabe von frischem L-15 Medium erhöhte sich der pO2 unterhalb der Epithelzellschicht auf normoxische Werte von etwa 150 Torr. Da die Zellen im Kanal Sauerstoff verbrauchten, ohne einen signifikanten O2-Einstrom von außerhalb, wurde eine überraschend schnelle Abnahme von 50 % pO2 innerhalb von (0,3 ± 0,1) Std. nach dem Austausch von L-15 Medium beobachtet. Der pO2 fiel innerhalb von (1,5 ± 0,2) Std. nach dem Mediumwechsel schnell auf hypoxische Werte unter 10 Torr ab. Die zeitabhängigen Sauerstoffprofile ermöglichen die Bestimmung der Sauerstoffverbrauchsraten (OCR) der untersuchten Zellen für diese genau definierten experimentellen Bedingungen, wie im nächsten Paragraph gezeigt wird.
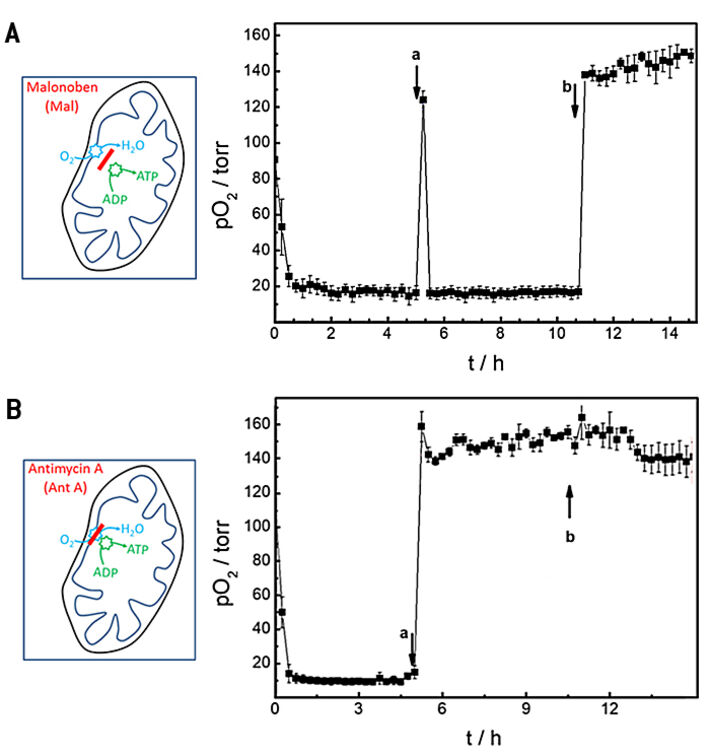
In weiteren Proof-of-Concept-Experimenten nutzen wir das offene mikrofluidische Kanalsystem mit integriertem O2 Sensor, um den Effekt bekannter Wirkstoffe auf die Sauerstoffverbrauchsraten von Zellen im Kanal zu untersuche. Zwei Stoffe mit etablierten Wirkungsmechanismen zur Entkopplung oder Blockierung der oxidativen Phosphorylierung wurden mit dem zusammengesetzten Gerät untersucht. Malonoben (Mal) wirkt als Entkoppler der Respiration und ATP-Produktion, während Antimycin A (Ant A) die Atmung blockiert. Wie bekannt ist, erhöhen Zellen ihre Sauerstoffverbrauchsrate, wenn sie Malonoben ausgesetzt werden, um die fehlende ATP-Synthese zu kompensieren. Im Gegensatz dazu stoppt Antimycin A den Sauerstoffverbrauch durch blockieren der mitochondrialen Atmung vollständig. Das Experiment wurde in einem konsekutiven dreistufigen Verfahren durchgeführt und die Oxygenierung im Chip wurde mit der Zeit verfolgt (Abb. 5). Zuerst wurde der basale Sauerstoffverbrauch in L-15 Standardmedium bestimmt, gefolgt von einem Pufferaustausch nach 5 Stunden zu L-15 Medium ergänzt mit 100 nM Mal (Abb. 5A) bzw. 2 µM Ant A (Abb. 5B). Schließlich wurden die Zellen mit 1 ml frischem L-15 Medium behandelt, das 0,3 % (Gew./Vol.) Saponin enthielt, einem Reinigungsmittel, das bekanntermaßen Zellen permeabilisiert. Während der Grundverbrauchsaufzeichnung nahm der pO2 aufgrund der Zellatmung innerhalb von etwa 0,75 Std. nach Beginn der Messung auf Werte unter 20 Torr ab, und die OCR in L-15 Medium wurde zu (26,9 ± 0,2) pmol s-1 bestimmt (Abb. 5A) Der Austausch von L-15 Medium durch L-15 Medium versetzt mit 100 nM Malonoben (Abb. 5A a) wurde von einer vorübergehenden Reoxygenierung des Kanals auf einen Wert von (124 ± 5) Torr begleitet. Die entkoppelnde Wirkung von Mal führte jedoch zu einem noch schnelleren Verbrauch des zur Verfügung stehenden Sauerstoffs durch die Zellen, wie bereits aus der Literatur bekannt ist. pO2 sank innerhalb von 0,25 Std. auf Werte unter 20 Torr. Der schnelle Sauerstoffverbrauch begrenzt die Genauigkeit der OCR-Bestimmung, die unter diesen Bedingungen zu (27,2 ± 0.1) pmol s-1 berechnet wurde. Die Zugabe von Saponin zum Inkubationsmedium (Abb. 5A b) permeabilisierte die Zellmembranen, so dass die Zellatmung irreversibel gestoppt wurde. Dementsprechend führte die Reoxygenierung des Kanals zu zeitunabhängiger Normoxie.
Die basale Sauerstoffverbrauchsrate, bevor die Zellen dem Atmungsinhibitor Antimycin A ausgesetzt wurden (Abb. 5B), ergab (28,3 ± 0,1) pmol s-1 in enger Übereinstimmung mit den oben angegebenen Werten. Sobald die oxidative Phosphorylierung durch Ant A irreversibel blockiert war, änderte sich die Reoxygenierung des Kanals mit Austausch des Mediums nicht mehr und verblieb bei Werten von (159 ± 9) Torr. Die Zugabe von Saponin hatte wie erwartet keine signifikanten zusätzlichen Auswirkungen. Dementsprechend sanken die OCR-Werte auf (4,1 ± 5,2 10-2) pmol s-1. Der große Standardfehler zeigt die begrenzte Genauigkeit der Messung, da kaum Sauerstoff verbraucht wurde. OCR in Gegenwart von Saponin wurde formal zu (0,3 ± 0,2) pmol s-1 bestimmt.
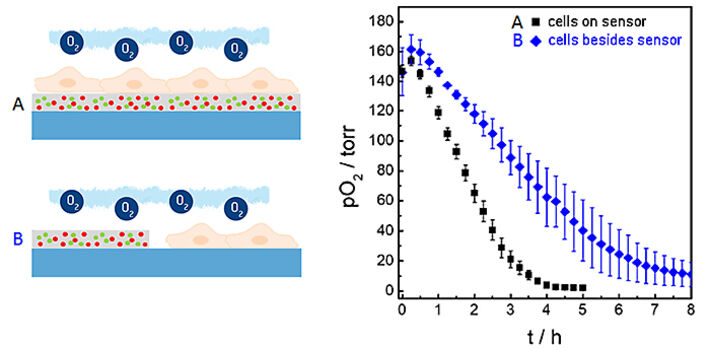
Bei den oben beschriebenen Messungen wurden die planaren O2 Sensorfolien gleichzeitig als Sensor und Wachstumssubstrat für die Zellen verwendet. Unter diesen Bedingungen liegt der Abstand zwischen der unteren Zellmembran und dem Sensor in der Größenordnung von 20 bis 200 nm, abhängig vom Zelltyp. Aufgrund (i) dieses geringen Abstands zwischen Membran und Sensoroberfläche, der durch Diffusion überbrückt werden soll, und (ii) der hohen O2-Permeabilität der Zellmembran bietet diese Architektur eine relativ kurze Reaktionszeit des Sensors und die einzigartige laterale Auflösung, wenn man Sauerstoffgradienten untersuchen möchte. Sensorfolien können jedoch auch zellfrei genutzt werden, um die Oxygenierung der Mikroumgebung neben den Zellen zu untersuchen. Abbildung 6 zeigt einen Vergleich der Sensorantwort, wenn die untersuchten Zellen direkt auf der Sensoroberfläche wie in den oben beschriebenen Beispielen (schwarze Kurve) oder daneben (blaue Kurve) kultiviert werden. Die zeitabhängige Abnahme von pO2 zeigt signifikante Unterschiede in diesen beiden experimentellen Situationen. Der Grund für die langsamere Abnahme von pO2, wenn die Zellen neben der Sensorfolie wachsen, ist der zusätzliche Diffusionsabstand zwischen den atmenden Zellen und dem Sensor sowie die Unterschiede in den Flüssigkeitsvolumina, die in beiden Anordnungen untersucht werden.
Diskussion und Schlussfolgerung
Unsere Studie zeigt, dass Sauerstoff direkt in mikrofluidischen Chips gemessen werden kann, indem Lumineszenzsensoren in das Wachstumssubstrat integriert werden. Diese markierungsfreie Messtechnik ermöglicht Messungen in sehr kleinen Volumina und ohne während der Messung den Analyten zu verbrauchen. Lumineszierende O2 Sensoren können als kleine Sensorspots für kontinuierliche Einpunkt-Messungen oder als planare Sensorfolien für lateral aufgelöste Studien, wie hier gezeigt, verwendet werden. Planare Sensorfolien ermöglichen ein quantitatives zweidimensionales Auslesen mit der Option, lokale Sauerstoffkonzentrationen und -gradienten in einem anpassbaren Sichtfeld zu analysieren, verschiedene Regionen zu vergleichen oder mehrere Experimente gleichzeitig in parallelen Kanälen zu überwachen. Im Hinblick auf die Oxygenierung von mikrofluidischen Zellkulturvorrichtungen muss das Gleichgewicht von Sauerstoffeinstrom und - verbrauch durch Atmung streng überwacht und eingestellt werden, da die meisten zur Herstellung mikrofluidischer Strukturen verwendeten Materialien nur eine sehr begrenzte Permeabilität für Sauerstoff aufweisen. Die Daten in dieser Studie zeigen, wie schnell die Mikroumgebung der Zellen unter statischen Kulturbedingungen hypoxisch wird, was einen großen Einfluss auf die Lebensfähigkeit und Proliferation der untersuchten Zellen hat. Die Kontrolle des O2-Gehalts und eine gut angepasste Perfusion sind in diesem System unabkömmlich, um den physiologischen Zellphänotypen und relevante Analysen von zellbasierten Assays so nahe wie möglich zu kommen.
Referenzen:
[1] Mehling M, Tay S (2014) Micorfluidic cell culture. Current Opinion in Biotechnology 25/95: 85-102
[2] Guansheng D, Fang Q, den Toonder JMJ (2016) Microfluidics for cell-based high throughput screening platforms—A review. Analytica chimica acta 903: 36-50
[3] Wahyu W (2014) Effect of oxygen tension on proliferation and characteristics of Wharton's jelly-derived mesenchymal stem cells. Biomarkers and Genomic Medicine 6(1): 43-48
Celeste SM, Keith B (2008) The role of oxygen availability in embryonic development and stem cell function." Nature Reviews Molecular Cell Biology 9(4): 285
[4] Brennan MD, Rexius-Hall ML, Elgass LJ, Eddington DT (2014) Oxygen control with microfluidics. Lab Chip. 14(22):4305-18