Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Nicht-invasives Verfahren zur Echtzeit-Überwachung von Sauerstoff während der Kultur von hämatopoetischen Stamm- / Progenitorzellen (HSPC)
Timothy McKinnon1, Nelli Baal2, und Marek Zygmunt2
1Samuel Lunenfeld Research Institute, Mount Sinai Hospital, Toronto, Kanada
2Universitätsklinikum Gießen und Marburg, Deutschland
Der SDR SensorDish® Reader von PreSens ermöglichte die Quantifizierung von Sauerstoffkonzentrationen in vitro während der Kultivierung von hämatopoetischen Stamm- / Vorläuferzellen (HSPC), die aus menschlichem Nabelschnurblut isoliert worden waren. Der Einfluss simulierter physiologischer Sauerstoffkonzentrationen auf die HSPC-Proliferation, den Zellzyklusstatus sowie die Expression von Markern des Stammzellphänotyps oder differenzierter Zelltypen wurde gleichzeitig mit Echtzeit-Überwachung der Sauerstoffkonzentrationen in den Zellkulturmedien untersucht. Diese Studie demonstrierte die Nützlichkeit dieses Systems zur Untersuchung des Zellphänotyps und der Zellfunktion unter Bedingungen, die die in vivo Sauerstoffumgebung effektiv nachahmen.
Die Sauerstoffkonzentrationen ändern sich während der Entwicklung des menschlichen Embryos dramatisch. Diese Veränderungen der Sauerstoffkonzentration sind am stärksten in der sich entwickelnden Plazenta. Trophoblastzellen gehören zu den frühesten Zelltypen, die sich in der menschlichen Plazenta bilden, und müssen sich daher bei vielen unterschiedlichen Sauerstoffkonzentrationen entwickeln. In ähnlicher Weise werden hämatopoetische und vaskuläre Vorläuferzellen in der frühen Plazenta zuerst in einer sauerstoffarmen Umgebung vorgefunden. Mit fortschreitender Entwicklung nehmen die Sauerstoffspannungen zu und sowohl die Trophoblasten als auch die Vorläuferzellen passen sich an die steigenden Sauerstoffkonzentrationen an. Wechselwirkungen zwischen Trophoblasten und Gefäßzellen sind äußerst komplex und wurden noch nicht ausreichend beschrieben. Es ist bekannt, dass Veränderungen der Sauerstoffkonzentration direkte Auswirkungen auf die Differenzierung von Trophoblasten und Gefäßzellen haben. Abnorme plazentare Sauerstoffkonzentrationen beeinflussen ebenfalls Wachstum und Entwicklung des Fötus und könnten schließlich zu einem erhöhten Risiko für fetale und mütterliche Morbidität und Mortalität führen. Aus diesem Grund ist es äußerst wichtig, dass Untersuchungen zu den Auswirkungen der Sauerstoffkonzentration auf das Wachstum der Plazenta und die Entwicklung der Gefäße fortgesetzt werden. Ein in vitro Kultursystem, das diese Veränderungen der physiologischen Sauerstoffkonzentrationen während der in vitro Zellkultur effektiv imitiert, würde sich in zukünftigen Studien als unersetzbar erweisen.

HSPC-Kultur bei physiologischen Sauerstoffkonzentrationen
CD133+ HSPC-Zellen, die aus humanem Nabelschnurblut isoliert worden waren, wurden für bis zu einer Woche in OxoDishes® mit 24 Wells von PreSens kultiviert. Alle 2 - 3 Tage wurden die Zellen und Kulturmedien entnommen, kurz zentrifugiert (1500 U/min; 5 min) und die Zellen sorgfältig in Medien resuspendiert, die für 1 h in der geeigneten Sauerstoffkonzentration (1 %, 8 % oder 20 %) vorinkubiert worden waren. Umgebungen mit niedrigem Sauerstoffgehalt wurden in dieser Zellkulturstudie mit einer Hypoxiekammer (Billups-Rothenburg, USA) erzeugt, die in einem herkömmlichen CO2-Inkubator platziert wurde (Abb. 1). Dieser Aufbau ermöglichte die Überwachung und Aufrechterhaltung spezifischer physiologischer Sauerstoffkonzentrationen in vitro. Sauerstoffkonzentrationen wurden online und in Echtzeit während der gesamten Inkubationszeit mit dem SDR überwacht. Gleichzeitig wurden HSPC-Zellen je nach Test in Platten mit entweder 24 oder 6 Wells und unter identischen Bedingungen, kultiviert. Wenn das Medium ausgetauscht wurde, wurde ein Aliquot entfernt und die Zellzahl unter Verwendung eines Casy® Counters bestimmt. Die durchflusszytometrische Messung des DNA-Gehalts ermöglichte die Untersuchung des HSPC-Zellzyklusstatus nach Kultur in physiologischen (1 % oder 8 %) oder Umgebungs-Sauerstoffkonzentrationen (20 %). In ähnlicher Weise wurden die Apoptoseniveaus unter Verwendung des FITX-Annexin-V-Apoptose-Kits (BD) in Kombination mit Durchflusszytometrie quantifiziert. Auf Proteinebene wurden Expressionsmuster extrazellulärer Marker von Stamm- / Progenitor- oder differenzierten Zellen unter Verwendung der multiparametrischen Durchflusszytometrie analysiert (Ergebnisse nicht gezeigt).
Ergebnisse
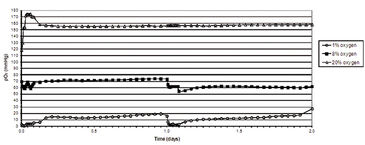
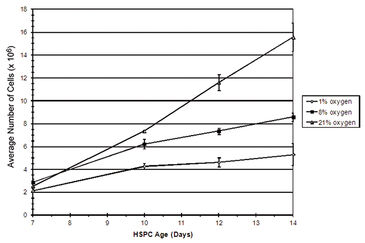
Abbildung 2 zeigt die in vitro Sauerstoffspannungen, die mit dem SDR in Kombination mit OxoDishes® während einer zweitägigen HSPC-Kultur in verschiedenen Sauerstoffumgebungen gemessen wurden. Eine durchschnittliche Sauerstoffspannung von 10,2 (± 5,5) mmHg konnte aufgezeichnet werden, wenn HSPC in 1 % O2 kultiviert wurden, und 65,0 (± 7,5) mmHg, wenn sie in 8 % O2 gehalten wurden. In Umgebungssauerstoff (20 % O2) betrug die durchschnittliche Sauerstoffspannung in HSPC-Kulturmedien 157,9 (± 9,2) mmHg. Um eine relativ stabile sauerstoffarme Umgebung zu erhalten, wurde in 24-Stunden-Intervallen die Atmosphäre in drei Stunden 1-mal pro Stunde ausgetauscht. In hyperoxischen Umgebungen zeigten HSPC eine erhöhte Proliferationsrate. HSPC-Wachstumskurven nahmen in einer sauerstoffkonzentrationsabhängigen Weise ab, wobei die geringste Zellproliferation in Umgebungen mit 1 % O2 beobachtet wurde (3). Die durchflusszytometrische Analyse des HSPC-DNA-Gehalts ermöglichte die Analyse des Zellzyklusstatus. Die Ergebnisse dieser Untersuchung zeigten deutlich, dass die Anzahl der ruhenden (d. h. G0) oder G1-Zellen signifikant anstieg, wenn die Sauerstoffkonzentration in der Umgebung abnahm. Die Sauerstoffkonzentration schien in diesem Experiment keine signifikante Auswirkung auf die HSPC-Apoptose zu haben (Daten nicht gezeigt). Zusammengenommen legen diese Ergebnisse nahe, dass, wenn HSPC unter Bedingungen kultiviert werden, die die in vivo Umgebung nachahmen, die Zellproliferation am wahrscheinlichsten aufgrund einer Zunahme der Anzahl ruhender Zellen (G0) und ohne signifikante Auswirkungen auf den Zelltod abnimmt. Diese Studie zeigt, dass die Sauerstoffkonzentration definitiv eine Wirkung auf den Phänotyp und die Funktion von Stamm- / Vorläuferzellen hat und begründet die These, dass Sauerstoff eine Schlüsselrolle bei der Plazentalentwicklung spielt.
Neue Perspektiven für nicht-invasive Sauerstoffüberwachung
Physiologische Sauerstoffkonzentrationen während verschiedener Zeitpunkte in der Entwicklung der menschlichen Plazenta konnten effektiv und mit überraschender Genauigkeit unter Verwendung von zwei verschiedenen Gasgemischen nachgeahmt werden, die entweder 1 % oder 8 % O2 (5 % CO2) enthielten. In dieser Studie vorgenommene Messungen mit dem SDR zusammen mit OxoDishes® lieferten zusätzliche Beweise, dass traditionelle Zellkultur bei Luftsauerstoff (20 % O2) eine deutlich hyperoxische Umgebung mit Sauerstoffspannungen erzeugt, die über dem normalen pO2 in menschlichen Geweben liegen. Die Verwendung von Gasgemischen mit geringem Sauerstoffgehalt ist in der Plazentaforschung nicht neu. Ein wichtiger Unterschied besteht jedoch darin, dass frühere Untersuchungen keine nicht-invasive Echtzeit-Sauerstoffüberwachung beinhalteten. Wie in dieser Untersuchung deutlich gezeigt wurde, sind die Sauerstoffkonzentrationen in Zellkultursystemen mit niedrigem Sauerstoffgehalt in einem konstanten Fluss und nur schwer bei physiologischen Niveaus zu halten. Dementsprechend war eine Standardisierung der Versuchsparameter (z. B. Zellzahl, Medienzusammensetzung, Gaswechselintervalle usw.) und umfangreiche Tests erforderlich, um sicherzustellen, dass die tatsächlichen physiologischen Sauerstoffkonzentrationen erreicht und anschließend aufrechterhalten wurden. Unter Verwendung standardisierter Protokolle wurde die Variabilität zwischen den Experimenten verringert. Darüber hinaus lieferte das SDR Sauerstoffüberwachungssystem verlässliche Daten über in vitro Sauerstoffkonzentrationen während der gesamten Versuchsdauer. Reproduzierbare Ergebnisse dieser Studie haben einen klaren Zusammenhang zwischen Sauerstoffkonzentration, Zellproliferation und Zellzyklusstatus gezeigt. Die Bedeutung dieser Ergebnisse für die Stamm- / Vorläuferzellkultur und -funktion wird in Zukunft genauer untersucht werden. Das SDR ermöglicht in vitro Studien, in denen definierte, physiologisch relevante Sauerstoffkonzentrationen und stabile Zellkulturbedingungen eine wichtige Rolle spielen. Darüber hinaus können Medienveränderungen oder Änderungen der Sauerstoffkonzentrationen in den Experimenten entsprechend überwacht und verändert werden. Mit diesem System werden Forschungsziele zeitnah erreicht und damit die Forschungskosten gesenkt.