Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Optrode Dual™ verbindet Single-Use Bioreaktoren mit konventionellen Controllern
Überwachung einer CHO-Zellkultivierung mit chemisch-optischen Sensoren
Stephan Kaiser, Franziska Fietz, Nina Steiger, und Dieter Eibl
Fachstelle Bioverfahrens- und Zellkulturtechnik, School of Life Sciences and Facility Management, Züricher Hochschule für Angewandte Wissenschaften, Schweiz
Der Optrode Dual™-Prototyp wurde für Messungen in suspensionsadaptierter CHO-Zellkultur eingesetzt. Der Transmitter wandelt die Daten der im Kultivierungsbeutel integrierten chemisch-optischen Sensoren in elektrochemische Signale um, die auf einen konventionellen Controller übertragen wurden. CHO-Zellkultur wurde für 5 Tage in diesem Aufbau erfolgreich durchgeführt. Die korrekte Funktionsweise des Optrode Dual™ während der gesamten Kultivierungszeit wurde bestätigt, obwohl es zu Bedienungsfehlern kam.

Die meisten Controller sind zur Sauerstoff- und pH-Überwachung für den Einsatz von elektrochemischen Sensoren ausgelegt. Das Optrode Dual™ wurde entwickelt, um die Auslesewerte von chemisch-optischen Sensoren in ein elektrochemisches Signal (ECS) umzuwandeln, das an die Steuerung übertragen werden kann. Auf diese Weise kann die Funktionalität konventioneller Controller erweitert werden, um auch mit optischen Sensoren die wichtigen Kulturparameter Sauerstoff und pH zu messen. Das Gerät ermöglicht auch eine sichere Kalibrierung der optischen Sensoren mittels 2D-Barcode-Steuerung. In den folgenden Tests wurde ein Prototyp des Optrode Dual™ auf seine Funktionalität in Kombination mit dem ez-control® von Applikon getestet. In einem Kultivierungsbeutel integrierte chemisch-optische Sensoren wurden ausgelesen und ihr Signal erfolgreich konvertiert und an den Controller übertragen. Die Kombination der Systeme verschiedener Hersteller funktionierte korrekt.
Material & Methoden
Der Optrode Dual™-Prototyp wurde an den ez-control® (Applikon, Niederlande) angeschlossen, der zur Datenerfassung per Ethernet-Kabel mit einem PC verbunden war (Abb. 1). Die Datenaufzeichnung für gelösten Sauerstoff und pH wurde mit der Software BioXpert (Version 2.93.122b2) mit einer Abtastrate von 1 min durchgeführt. Die Kalibrierung der optischen Sensoren in einem 20 l Kultivierungsbeutel wurde mit dem Optrode Dual™ durchgeführt. Dafür wurde mit der QR Code Generator Software im manuellen Modus ein spezifischer Barcode generiert. Der Kultivierungsbeutel wurde auf einer BioWave 20 SPS-Plattform (Wave Biotech, Schweiz) platziert. Für die Kultivierung wurden suspensionsadaptierte CHO-Zellen (CHO XM111-10, bezogen von Fussenegger et al., ETH, Zürich) verwendet, die einen Tetracyclin-regulierten Promotor für die SEAP-Expression (sezernierte alkalische Phosphatase) hatten. Es wurde jedoch nur ein Wachstumsexperiment ohne Produktbildung durchgeführt. Der Kultivierungsbeutel wurde 3 h vor der Inokulation mit 1,5 l chemisch definiertem Medium (CHO Master HP1, Zellkulturtechnologien) gefüllt, das Tetracyclin (2,5 mg l-1) und Pluronic F68 (2 mg l-1) enthielt. Das Medium wurde auf 37 °C angeglichen und belüftet, bis es gesättigt war. Der Bioreaktor wurde mit 0,5 × 106 Zellen ml-1 mit einem Ausgangsvolumen von 2,4 l inokuliert. 48 Stunden und 72 Stunden nach der Beimpfung wurden 3 l bzw. 5 l frisches Kulturmedium zugegeben. Winkel und Bewegungsgeschwindigkeit des Kultivierungsbeutels wurden an das Füllvolumen des Bioreaktors angepasst, um eine optimale Durchmischung zu gewährleisten. Proben von etwa 5 ml Volumen wurden viermal täglich entnommen. Zellzählung und Bestimmung der Zelllebensfähigkeit wurden automatisch mit NucleoCounter NC-100 (Chemometec, Dänemark) durchgeführt. Außerdem wurde der pH-Wert offline mit einem pH-Meter (Mettler Toledo, Schweiz) gemessen.
Überwachung der CHO-Zellkultur
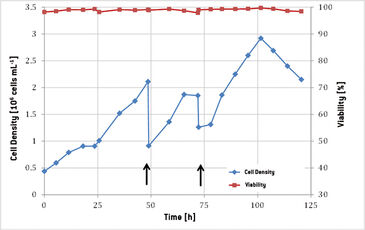
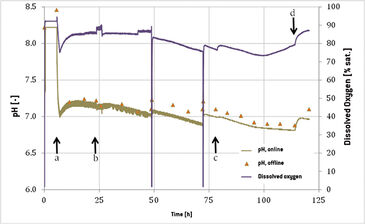
Die Funktionalität des Optrode Dual™ während der Kultivierung suspensionsadaptierter CHO-Zellen wurde in dieser Versuchsanordnung getestet. Die Änderung der Zelldichte und Lebensfähigkeit während der gesamten Kultivierungsperiode ist in Abb. 2 gezeigt. Die anfängliche Dichte von 0,5 × 106 Zellen ml-1 stieg innerhalb von 48 Stunden auf einen Wert von 2,11 × 106 Zellen ml-1 und zeigte eine Wachstumsrate von 0,03 h-1. 25 Stunden nach dem Beimpfen stagnierte das Zellwachstum. Die anfängliche Bewegungsgeschwindigkeit von 15 U/min wurde auf 19 U/min erhöht und die Begasung von 0,2 slpm (Standardliter pro Minute) wurde auf 0,4 slpm (0,1 VVM zu 0,2 VVM) eingestellt, wodurch das Kulturwachstum wiederhergestellt wurde. Nach 48 Stunden wurde dem Bioreaktor frisches Medium zugegeben und eine weitere Periode von exponentiellem Wachstum mit einer Verdopplungsrate von 23 Stunden konnte beobachtet werden. 72 Stunden nach dem Beimpfen wurden weitere 5 l Medium zugegeben. Die maximale Zelldichte von 2,88 × 106 Zellen ml-1 wurde nach 100 Stunden Kultivierung erreicht. In den letzten 24 Stunden nahm die Zelldichte ab und erreichte 2,15 × 106 Zellen ml-1 mit einer Lebensfähigkeit von 98 %, als die Kultivierung beendet wurde. Online aufgezeichnete Daten für gelösten Sauerstoff (DO) und pH-Wert sind in Abb. 3 gezeigt. Während der ersten 6 Stunden der Kultivierung wurde ein konstanter pH-Wert von 8,22 gemessen, da die Kalibrierung des Sensors aufgrund eines Bedienungsfehlers nicht korrekt durchgeführt wurde. Der Barcode wurde zwar vom Optrode Dual™ gelesen, die Messung wurde jedoch nicht neu gestartet. Außerdem funktionierte die CO2-Versorgung nicht richtig, so dass der pH-Wert erst nach 10 Stunden auf 7,2 eingestellt werden konnte. Aufgrund des erhöhten CO2-Einstroms in den Beutel nahm der Gehalt an gelöstem Sauerstoff von 92 % auf 77 % ab und stieg wieder an, nachdem die Begasung mit 10 % CO2 korrekt auf 0,2 slpm eingestellt worden war. Eine weitere Erhöhung des DO-Spiegels wurde nach 24 Stunden beobachtet, als die Begasung und die Bewegung des Bioreaktors geändert wurden. Um das Gewicht des Bioreaktors während der Medienzugabe zu bestimmen, wurde er aus dem Kontrollsystem genommen, weshalb die DO-Messung bei 48 und 72 Stunden aussetzte. Gleichzeitig stieg der pH-Wert unter Zugabe des leicht basischen Mediums um 0,1 beziehungsweise 0,3 pH-Einheiten an. Nach 77 Stunden Kultivierung konnte eine weitere DO-Zunahme beobachtet werden, verursacht durch die zweite Erhöhung der Begasung auf 0,5 slpm. Ab der Stunde 100 erhöhte sich DO aufgrund des abnehmenden Zellwachstums von 75 % auf 80 %. Die letzte DO-Erhöhung wurde nach 110 Stunden Kultivierungszeit gemessen, als die CO2-Zufuhr abgeschaltet wurde. Der pH wurde offline gemessen, um die Online-Sensordaten zu verifizieren. Während der gesamten Kultivierung konnten Abweichungen in einem akzeptablen Bereich von unter 0,2 pH-Einheiten festgestellt werden, wobei die offline bestimmten Werte immer höher waren. Dies wurde wahrscheinlich durch den Zeitunterschied zwischen der Probenahme und der Messung verursacht, währendessen das pH-regulierende CO2 aus dem Medium entweichen konnte und sich der pH-Wert erhöhte.
Zusammenfassung
Der hier beschriebene Test wurde entwickelt, um die korrekte Funktionsweise des Optrode Dual™ zur Überwachung einer CHO-Zellkultur zu bewerten. Das Gerät wurde erfolgreich mit den optischen Sensoren im Kultivierungsbeutel verbunden und es konnten genaue Messdaten aufgezeichnet werden. Während der gesamten 5 Testtage traten keine funktionalen und technischen Fehler auf. Das Optrode Dual™ erwies sich als ein zuverlässiges Werkzeug um Kulturparametern mit optischen Sensoren zu messen und die Daten auf einen herkömmlichen Controller zu übertragen. Es ist zeitsparend, da es leicht an die elektrochemischen Eingänge der Steuerung angeschlossen werden kann und keine weiteren Änderungen der Reglereinstellungen notwendig sind. Mit dem Optrode Dual™ ist es möglich, Kosten zu sparen, da der Kauf neuer Prozessanalyse-Tools zum Lesen optischer Sensoren nicht notwendig ist und eine nicht-invasive Überwachung von pH und Sauerstoff durchgeführt werden kann.