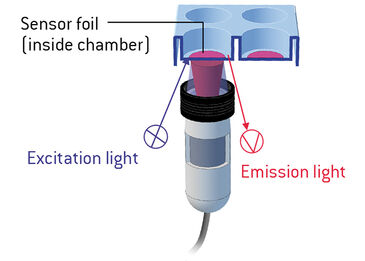
Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
pO2-Überwachung in Zellkultur zur Verbesserung der gesteuerten Differenzierung
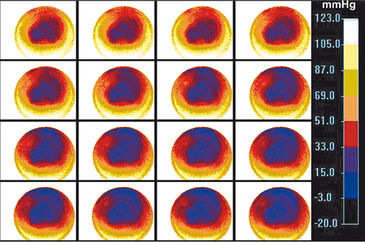
Visualisierung der Sauerstoffverteilung in 6-Well-Platten mit VisiSens™ A1
S. M. Rolandin1,2, C. Fraker1, V. Manzoli1, C. Villa1,2, A. A. Tomei1, Y. Torrente2, L. Inverardi1, J. Dominguez-Bendala1
1Diabetes Research Institute, University of Miami Miller School of Medicine, USA
2Stem Cell Laboratory, Department of Pathophysiology and Transplantation, Fondazione Ca´Granda IRCCS, Ospedale Maggiore Policlinico, Centro Dino Ferrari, Universita di Milano, IT
Die Gewebsoxygenierung ist während der in vitro Kultivierung von Stammzellen ein entscheidender Faktor. Frühere Studien haben gezeigt, dass die Aufrechterhaltung eines pO2, in Konzentrationen nahe der physiologischen Nische der Zielpopulation, die terminale Differenzierung während der in vitro Kultur signifikant verbessern kann. In dieser Studie wurde das VisiSens™ Sauerstoff-Bildgebungssystem in einer 6-Well-Platte mit immortalisierten C2C12-Zellen angewendet, um räumliche und zeitliche Veränderungen der Sauerstoffkonzentrationen über die Fläche der Zellkultur zu untersuchen. Im Laufe der Messperiode nahm der Sauerstoffgehalt in der Nähe der Zellen ab. Erste Ergebnisse zeigen, dass die Sauerstoffkonzentrationen über den Querschnitt der Zellkultur im Laufe der Zeit signifikant variieren können und dass VisiSens™ ein geeignetes Werkzeug für das Sauerstoffmonitoring im Bereich der Stammzellforschung ist. Die Implementierung dieser Sensoren, um Kulturbedingungen in Echtzeit zu überwachen, könnte erheblich dazu beitragen, reproduzierbare Umgebungsbedingungen zu schaffen und die Protokollstandardisierung und Differenzierungsergebnisse zu verbessern.
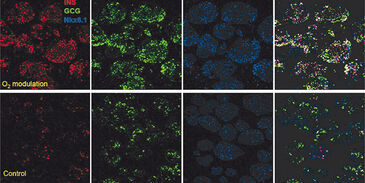
Bisher brachten Bemühungen, die zielgerichtete Entwicklung von Stammzellen während der in vitro Kultur effizient zu steuern, nur begrenzten Erfolg. Ein Grund könnte die Einfachheit von in vitro Kultursystemen sein, die nicht der Komplexität von Mikroumgebungen in vivo gleichkommen. Da der Fokus bisher auf molekularen Variablen lag, sind aktuelle Differenzierungsmethoden ineffizient und liefern selten voll funktionsfähige Zielzellen. Neuere Forschungen mit Stammzellen konzentrieren sich nun auch auf kritische und wichtige physikalische Parameter, wie z. B. Zugkräfte, ionische Signalisierung und mechanischen Druck als Schlüsselfaktoren für die Zelldifferenzierung. In einer früheren Studie haben wir gezeigt, dass die Gewebeoxygenierung während der in vitro Kultur auch ein wichtiger Parameter bei der Spezifizierung von endokrinen Zelltypen ist. Wenn die Kultur auf Niveaus gehalten wird, die sich der physiologischen Nische der Zielzellenpopulation annähern, zeigen Immunfluoreszenz-Ergebnisse (1) eine höhere Expression von Insulin und Glucagon mit verbesserter Trennung der Hormon-Kolokalisierung im Vergleich zu Standard-Kulturkontrollen.
Die Gewebsoxygenierung während der in vitro Kultur hängt von Faktoren wie der zellulären Sauerstoffverbrauchsrate (OCR), der Proliferation / dem Zelltod, der Plattierungsdichte und der mittleren Tiefe ab. Insbesondere können die OCR- und Proliferationsraten von Passage zu Passage signifikant variieren. Solche Variablen werden jedoch häufig übersehen und könnten zu der beobachteten Variabilität in Stammzellkultur und -differenzierung führen. Die Verwendung von Biosensoren zur Online-Kontrolle der Kulturumgebung könnte die Variabilität in Differenzierungsprotokollen verringern und die Standardisierung der Differenzierung verbessern. In dieser Studie haben wir das VisiSens™ Sauerstoff-Bildgebungssystem auf seine Eignung für die Online-Sauerstoffüberwachung von Stammzellkulturen und die weitere Anwendung in der Stammzellforschung getestet. Es wurde in C2C12-Zellkulturen angewendet, um erste Einblicke in die Sauerstoffverteilung an der Kulturoberfläche zu erhalten.
Material & Methoden
Wir haben die VisiSens™ Sauerstoffsensorfolien (SF-RPSu4, PreSens, Regensburg) in eine 6-Well-Platte integriert. Die Sensoren wurden unter Verwendung von DMEM Hi, suspendiert mit 10 % FBS, 1 % P/S und L-Glutamin für 100 % Luftsättigung, und 100 mM Natriumhydrosulfit, gelöst in dDH2O für 0 % Sauerstoffsättigung kalibriert. Dann wurden C2C12-Zellen mit einer Dichte von 1,03 × 105 Zellen/Inch in 1,6 % w/v Alginatlösung auf der Oberseite der Sensorfolie ausplattiert. Alginat wurde für 10 Minuten mit 50 mM CaCl2-Lösung geliert und dann gewaschen, wobei DMEM Hi für die Übernachtkultur zugegeben wurde. Die 6 Well Platte mit den Zellen und die VisiSens™ Detektoreinheit (DU01, PreSens) wurden in einen befeuchteten Standard-Inkubator mit 10 % O2 und 5 % CO2 gegeben. Nach fünf Minuten wurde das Imaging gestartet, und für eine Dauer von 16 Stunden wurden Aufnahmen gemacht. Nach der Aufnahme der Bilder wurden die Daten und Sauerstoffprofile über die gesamte Sensoroberfläche mit der VisiSens™ AnalytiCal 1 Software analysiert.
Sauerstoffimaging in Zellkultur
Tests mit dem VisiSens™ Sauerstoff-Bildgebungssystems und der immortalisierten Muskelzelllinie C2C12 zeigten die Eignung dieses Geräts zur Überwachung von Sauerstoffgradienten mit hoher räumlicher Auflösung über die Zellkulturoberfläche hinweg. Wie in Abbildung 3 dargestellt ist, sind die Sauerstoffkonzentrationen in Bereichen mit höherer Zelldichte signifikant niedriger als im umgebenden Medium. Eine weitere Sauerstoffabnahme wurde im Zentrum der Kultur während der nächsten 80 Minuten beobachtet (4). Das System erlaubte es, Echtzeitinformationen zu den Sauerstoffwerten über einen Querschnitt der Zellkultur zu erhalten. Da die Detektoreinheit leicht in die kontrollierte Umgebung eines Inkubators eingesetzt werden kann, ist das System ideal für die Zellkulturüberwachung geeignet. Die Implementierung dieser Sensoren und des VisiSens™ Imagingssystems für Echtzeit-Kulturüberwachung könnte die Reproduzierbarkeit der Umweltbedingungen signifikant verbessern und damit die in vitro Reifung steuern und optimieren.
Zusammenfassung
Es ist klar, dass Sauerstoff eine signifikante Rolle bei der Differenzierung von Vorläuferzellen spielt, und die Modulation dieses kritischen Umweltfaktors könnte wesentlich effizientere Stammzelldifferenzierungsprotokolle schaffen. Die Anwendung von VisiSens™ und der fluoreszierenden Sensorfolien ermöglicht eine online 2D-Überwachung von Sauerstoffgradienten über die Zellkulturoberfläche, so dass die Sauerstoffkonzentrationen bei Bedarf angepasst werden können. Bei der Untersuchung der Rolle von O2 in der Pankreasentwicklung könnte die Verwendung der Sensoren neue experimentelle Strategien zur Verbesserung der Effizienz existierender Beta-Zelldifferenzierungsprotokolle liefern. Durch die Charakterisierung von O2-Konzentrationen, denen Zellen während der herkömmlichen und modulierten Sauerstoffkultur ausgesetzt sind, und durch die Integration dieser Informationen in das Design effektiver Beta-Zelldifferenzierungsprotokolle könnte die klinische Übertragung von stammzellbasierten Ansätzen zur Behandlung von insulinabhängiger Diabetes beschleunigt werden. Ein in vitro Kultursystem, bei dem Online-Sensorfeedback, wie es VisiSens™ liefert, verwendet wird, um Umgebungsvariablen wie pO2 als Reaktion auf Veränderungen in OCR, Zellwachstum, Zelltod und Remodellierung präzise zu steuern und anzupassen, könnte helfen optimale physiologische Niveaus zu sichern und die Variabilität und Unzulänglichkeiten der derzeitigen in vitro Kultivierungsmethoden zu überwinden.
Applikationsbericht nach
S. M. Rolandin, et al.: Temporal monitoring of pO2 in cell cultures: a potential tool for directed differentiation; wissenschaftliches Poster, World Stem Cell Summit 2012