Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Sauerstoff-Überwachung in perfundiertem Muskelgewebe unter Verwendung von Durchflusszellen FTC-PSt3
K. Präbst1, A. Dragu2, C. Taeger2, B. Sommerfeldt1, H. Hübner1, R. Buchholz1, R. E. Horch2
1Lehrstuhl für Bioverfahrenstechnik, FAU Erlangen-Nürnberg, Deutschland
2Abteilung für Plastische und Handchirurgie, Universitätsklinikum Erlangen, FAU Erlangen-Nürnberg, Deutschland
Muskelgewebe ist sehr empfindlich gegenüber ischämischen Bedingungen, was die verfügbare Zeit, um freies Muskelgewebe zu transplantieren, stark begrenzt. Der freie Muskellappentransfer umfasst die Trennung der Blutgefäße des Muskels und das Wiederverbinden der Hauptgefäße mit der nativen Blutversorgung im Empfängerbett. Zwischen der Entnahme und der Anastomose der Gefäße des Lappens ist das Gewebe Ischämie ausgesetzt. Das Überschreiten der kritischen ischämischen Phase kann zu Apoptose und sogar Nekrose des Gewebes führen, was oft zu partiellem oder totalem Verlust des Transplantates führt. Für die Überbrückungszeit während intraoperativer Komplikationen, die es erforderlich machen den freien Muskellappen zu lagern, wird ein extrakorporales Perfusionssystem getestet, um das Gewebe am Leben und transplantierbar zu erhalten. Sauerstoff als kritischer Parameter wurde während der Perfusionsexperimente mit Durchflusszellen FTC-PSt3 online überwacht, die mit einem Mehrkanal-Sauerstoffmessgerät (OXY-4 mini) von PreSens verbunden waren. Die Ergebnisse zeigten einen aktiven Verbrauch des Gesamtsauerstoffs, der durch das Perfusat in kristalloiden Lösungen bereitgestellt wurde, weshalb eine aktive Oxygenierungseinheit, die im Perfusionszyklus implementiert ist, wünschenswert wäre.
Die Transplantation von freiem Gewebe ist eines der komplexesten Verfahren in der modernen Transplantationsmedizin und rekonstruktiven Mikrochirurgie. Die Übertragung von freien Lappen ist manchmal die einzige Behandlungsmöglichkeit für die Rekonstruktion von großen und komplexen Gewebsdefekten aufgrund von traumatischen Verletzungen mit freiliegenden Vitalstrukturen oder nach Tumorresektionen. Techniken zur Transplantation von autologen freien Lappen haben enorm an Komplexizität gewonnen, aber es bleibt ein schwieriger chirurgischer Eingriff. Freie Lappen leiden zwischen Gewebeentnahme und Anastomose der adhärenten Blutgefäße unter Ischämie. Ischämie-Reperfusionsverletzungen sind für das Gewebe sehr gefährlich, und können letztlich zu einem teilweisen oder vollständigen Lappenverlust führen.
Material & Methoden
Muskelgewebe zeigt im Vergleich zu anderen Gewebearten eine starke Empfindlichkeit gegenüber ischämischen Bedingungen. Die Überschreitung der kritischen Ischämiedauer führt zu einer signifikanten Zunahme von apoptotischen und nekrotischen Schäden. Diese Studie ist Teil eines Projekts zur Evaluierung eines miniaturisierten, extrakorporalen Perfusions- und Oxygenierungssystems, das das Problem einer länger andauernden Ischämie-Exposition vitaler muskulöser freier Lappen aufgrund intraoperativer Komplikationen zu umgehen versucht. Zu diesem Zweck wurde das kaudale Segment des M. rectus abdominis von ausgewachsenen deutschen Schweinen mit dem Perfusionssystem verbunden. Dieser Muskel weist eine bemerkenswerte Ähnlichkeit mit seinem menschlichen Analogon auf. Die Blutversorgung des Muskels findet hauptsächlich durch zwei große Gefäße statt, die Arteria epigastrica superior am kranialen und die untere epigastrischen Arterie am kaudalen Ende des Muskels mit ihren entsprechenden Venen. Für Perfusionsexperimente wurde der Muskel zwischen den unteren Verzweigungen aufgeschnitten und nur das kaudale Segment verwendet, wobei die untere epigastrische Arterie und Vene offen für die Perfusion blieben. Das System selbst bestand aus einer klinisch integrierten Infusionspumpe (Infusomat Space P, B. Braun Melsungen), die Perfusionsflüssigkeit aus einem Reservoir ansaugte und zur katheterisierten Arteria epigastrica inferior des gelagerten Muskels transportierte. Perfusat, das aus dem venösen Zweig des epigastrischen Gefäßes austrat, wurde zum Reservoir zurückgeführt, so dass der Perfusionskreis geschlossen war. Für die Online-Überwachung wurden Durchflusszellen mit chemisch-optischen Sauerstoffsensoren (FTC-PSt3-L2.5, PreSens GmbH) in den arteriellen und venösen Fluss des Perfusionssystems integriert. Die Sensoren waren an ein Mehrkanal-Sauerstoffmessgerät angeschlossen (OXY-4 mini, PreSens GmbH). Die Überwachung von Sauerstoff ist entscheidend für den Erfolg der Perfusion von Muskelgewebe, um Hypoxie zu verhindern. Die von PreSens angebotenen Sensoren sind minimal invasiv und aufgrund ihrer schnellen Ansprechzeit ideal für diese Zwecke geeignet. Diese optischen Sauerstoffsensoren messen unabhängig von Strömungsgeschwindigkeiten und haben keine Querempfindlichkeiten mit Salz, pH-Wert oder gelöstem CO2 und SO2 im Medium, was zusätzlich von Vorteil ist. Der Perfusionsstrom wurde auf 600 ml/h eingestellt, um die physiologische intravaskuläre Flussrate und den Druck festzulegen. Erste Experimente wurden mit einer kristalloiden Infusionslösung (Jonosteril, Fresenius Kabi) und Eigenblut durchgeführt. In beiden Fällen wurde Heparin als Antikoagulans verwendet (500 I.E./l).
Ergebnisse
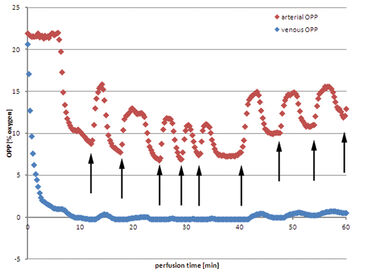
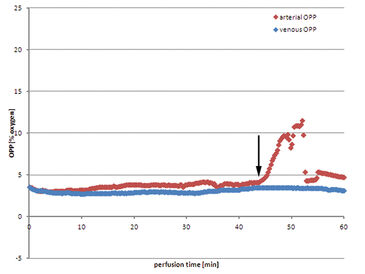
Unter Verwendung von Jonosteril als Perfusat konnte in allen Experimenten erfolgreich ein kontinuierlicher Fluss von 600 ml/h etabliert werden, um einen moderaten intravaskulären Druck sicherzustellen. Die folgenden Daten sind ein repräsentatives Beispiel für alle Experimente. Der venöse Sauerstoffpartialdruck (OPP) fiel fast unmittelbar nach der Initialisierung der Perfusion ab (Abb. 1). Nach neun Minuten sank der Wert auf 0 % OPP im venösen Perfusat. Auf der arteriellen Seite blieb OPP auf einem konstanten Ausgangsniveau, etwa 21,0 %, und fiel nach sechs Minuten ab, da venöses sauerstoffarmes Perfusat aufgrund der Systemkonformation eines geschlossenen Kreislaufes in das Reservoir zurückgeführt wurde und sich mit der verbliebenen Flüssigkeit vermischte. Arterielles OPP fiel anschließend auf ein Minimum von 8,8 %, bevor frisches sauerstoffgesättigtes Perfusat in das Reservoir gefüllt werden musste, um den Perfusatverlust, durch unvermeidlich während der Entnahme verletzte kleinere Gefäße des Muskels, auszugleichen. Daher stieg der arterielle OPP an, bevor die Sauerstoffkonzentration im Reservoir durch kontinuierliches Mischen mit venösem Perfusat verringert wurde. Dieser Vorgang wiederholt sich, wobei der arterielle OPP periodisch zwischen 16,2 % und 7,4 % schwankte. Venöse OPP waren dagegen von diesen Schwankungen weitgehend unbeeinflusst und blieben weiterhin bei niedrigen Werten nahe 0 %. Das Gewebe verbrauchte also aktiv Sauerstoff. Die Verwendung von autologem Blut als Perfusat zeigt einige wesentliche Nachteile. Trotz der extensiven Verwendung von Heparin schien die Koagulation im Perfusionssystem unvermeidlich zu sein. Die Perfusion musste mit niedrigeren Raten von bis zu 400 ml/h initialisiert werden, um hohe intravaskuläre Drücke zu verhindern, bevor die Perfusionsrate langsam auf 600 ml/h erhöht wurde. Der arterielle OPP blieb von Beginn der Perfusion an auf einem niedrigen Niveau, zwischen 3,0 % und 4,1 %. Venöser OPP zeigte nur geringfügig niedrigere Werte und blieb über die gesamte Perfusion zwischen 2,8 % und 3,5 %. Perfusatverlust machte das Nachfüllen des Reservoirs mit frischem, gesammeltem Eigenblut notwendig, wobei kein Anstieg des Sauerstoffgehalts gemessen werden konnte. Nach 42 Minuten konnte die große Menge an Perfusatverlust nicht mehr mit gesammeltem Blut ausgeglichen werden, so dass ausgetretenes Perfusat gesammelt und erneut in das Perfusionssystem eingebracht wurde. Das der Umgebungsluft ausgesetzte Blut war mit Sauerstoff gesättigt, was zu einem Anstieg des OPP nach dem Einfüllen in das Reservoir führte. Venöser OPP blieb von dem gleichzeitigen Anstieg des arteriellen OPP unbeeinflusst.
Diskussion
Die Perfusatlösung spielt eine wichtige Rolle bei der extrakorporalen Versorgung von Muskelgewebe. Unter Verwendung einer kristalloiden Lösung kann von Anfang an ein kontinuierlicher Fluss hergestellt werden, es findet keine Koagulation statt, und ausgetretenes Perfusat kann leicht ausgeglichen werden. Die Bildung von Gewebeödemfluid stellt jedoch immer noch einen wesentlichen Nachteil dar. Daher wird für zukünftige Anwendungen der Einsatz kolloidaler Lösungen in Betracht gezogen. Diese Lösungen werden in vielen Anwendungen für die Konservierung von Organtransplantaten eingesetzt und es hat sich gezeigt, dass die Bildung von Ödemen aufgrund des niedrigeren kolloidosmotischen Drucks reduziert werden kann. Bislang kann eine stabile Perfusion über einen Zeitraum von 1 h aufrechterhalten werden. Aufgrund der ersten Ergebnisse können längere Perfusionszeiten angestrebt werden. Die hier vorgelegten OPP-Werte zeigen, dass eine zusätzliche komplementäre Oxygenierungseinheit wünschenswert wäre, es andererseits aber auch möglich ist, Hypoxie abzufangen, indem der Muskel extrakorporal mit einem oxygenierten Perfusat durchströmt wird. Zu diesem Zweck sollte ein sekundären Oxygenierungskreislauf implementiert werden, der den verbrauchten Sauerstoff im Perfusat nachliefert, um eine Sauerstoffsättigung und eine Entsättigung des Kohlendioxidaufbaus sicherzustellen. Eine weitere Möglichkeit, die extrakorporale Perfusion zu optimieren, ist die aktive Regulierung der Gewebetemperatur zur Verbesserung der Gewebekonservierung. Die Einführung einer immunhistochemischen Untersuchung von Gewebeproben während der aktiven Perfusion zur Bestimmung von ischämischen und apoptotischen Markern zur Verbesserung der Perfusionsergebnisse wird zusätzliche Einblicke in die Perfusionsqualität liefern.
Applikationsbericht nach
Dragu A, Taeger CD, Buchholz R, Sommerfeld B, Hübner H, Birkholz T, Kleinmann JA, Münch F, Horch RE, Präbst K.., 2012 Jan 15., Online oxygen measurements in ex vivo perfused muscle tissue in a porcine model using dynamic quenching methods, Arch Orthop Trauma Surg. [Epub ahead of print]