Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Räumlich-zeitliche O2 Gradienten in der Mikroumgebung einer auswachsenden Zellfläche
Sauerstoffimaging im Mikromaßstab mit dem VisiSens TD MIC System
C. Schmittlein1, R. J. Meier2, J. Wegener1,3
1Institut für Analytische Chemie, Chemo- und Biosensorik, Universität Regensburg, Regensburg, Deutschland
2PreSens Precision Sensing GmbH, Regensburg, Deutschland
3Fraunhofer-Einrichtung für Mikrosysteme und Festkörper-Technologien (EMFT), Regensburg, Deutschland
Zellbasierte Assays haben sich in allen Bereichen der biomedizinischen Wissenschaften zu einem unverzichtbaren Werkzeug entwickelt. Zellkulturexperimente in einer Laborumgebung werden jedoch immer nach ihrer physiologischen Relevanz im Allgemeinen und ihrer Übereinstimmung mit der physiologischen Mikroumgebung im Besonderen in Frage gestellt. Beispielsweise wird die Sauerstoffversorgung in 2D-Zellkulturexperimenten nicht routinemäßig kontrolliert, obwohl Hypoxie, d. h. O2-Werte niedriger als die Luftsättigung, vielen Gewebetypen im Tierkörper gemeinsam ist. Die meisten Zellkulturen werden jedoch unter "Standardbedingungen" (95% Luft, 5% CO2, 37 ºC) durchgeführt, so dass der Sauerstoffgehalt in der Zellkulturflüssigkeit nicht physiologisch ist. Statische Zellkulturen bilden eine zelltypabhängige Mikroumgebung, die das Ergebnis der Zellatmung, der Proliferation und der endlichen Diffusionsraten in statischen Medien ist. Ziel dieser Studie war es, die lokale O2-Konzentration in der Mikroumgebung anhaftender Zellflächen zu messen, die sich vermehren und ausbreiten dürfen. Die lokalen Sauerstoffwerte wurden mit dem 2D Sauerstoff-Bildgebungssystem VisiSens TD MIC gemessen, das in einen Standard-48l-Inkubator passt und die Überwachung anhaftender Zellen unter variablen Kulturbedingungen ermöglicht. Die Kernkomponente der Messung sind O2-Sensorfolien (SF-RPSu4, PreSens), die als Kultursubstrate für die untersuchten adhärenten Zellen verwendet wurden. Die unmittelbare Nähe von Zellen und optischer Sensorschicht ermöglicht Messungen der pO2-Spiegel in der Mikroumgebung unter der anhaftenden Zellschicht. Das VisiSens TD MIC-System wurde verwendet, um zeitliche und räumliche Änderungen von O2-Gradienten, die durch aktiv atmende und migrierende Flächen anhaftender Zellen verursacht wurden, nicht-invasiv zu messen.
Material & Methoden
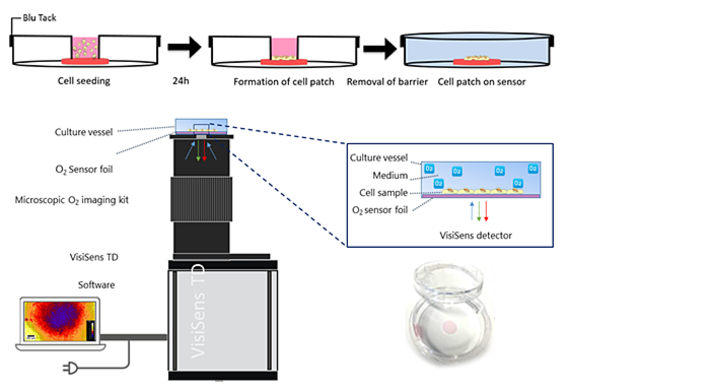
Die O2-Niveaus in der zellulären Mikroumgebung wurden unter Verwendung des VisiSens TD-Bildgebungssystems quantifiziert und sichtbar gemacht, das mit einer Mikroskopoptik und einer passenden Lichtquelle für die Analytkartierung im kleinen Maßstab ausgestattet war. Das System bietet eine 2-fache Vergrößerung. Ein rundes Stück der O2-empfindlichen planaren Sensorfolie (SF-RPSu4) mit einem Durchmesser von 0,7 cm wurde unter Verwendung eines biokompatiblen Silikonklebstoffs auf den Boden einer Standard-Petrischale mit einem Durchmesser von 3,5 cm geklebt. Wir ließen den Kleber mindestens 24 Stunden trocknen, bevor die Experimente durchgeführt wurden. Die optische Isolationsschicht wurde von der Sensorfolie entfernt. Vor dem Aussäen der Zellen wurden die Petrischalen, die die Sensorfolien enthielten, 1 Minute lang Argonplasma ausgesetzt, um die Oberfläche zu reinigen und zu sterilisieren (siehe Abb. 1). Um ein kleines Zellfeld zu erzeugen, das kleiner als die Sensorfolie ist, wurden suspendierte Zellen in einen kleinen Einsatz ausgesät. Dieser diente als physikalische Barriere und verhinderte so die Ausbreitung von Zellen auf der gesamten Sensoroberfläche. Die Petrischale war mit einem Deckel bedeckt, der einen kleinen Einlass zum Aussäen der Zellen enthielt. Der Rand des Deckels wurde mit einer dünnen Schicht Blu-Tack® beschichtet und fest auf den unteren Teil am Boden der Petrischale gedrückt. Die mechanische Belastung des Deckels drückte den Barriereeinsatz nach unten, so dass keine Zellsuspension austreten konnte. 100 µl Zellsuspension (2,0 · 105 Zellen cm-2, Wachstumsfläche = 3,2 mm2) wurden in das innere Kompartiment des Einsatzes gegeben. Die Zellen wurden 24 h bei 37 ° C, 95% Luft und 5% CO2 inkubiert. Dann wurden Deckel und Einsatz entfernt und die Probe zweimal mit 1 ml L-15-Medium gewaschen. Die Petrischale wurde mit 9,6 ml L-15-Medium gefüllt und mit einem neuen Deckel ohne Öffnung luftdicht verschlossen. Die Zweipunktkalibrierung des O2-Sensors wurde durch Aufbringen von Zellkulturmedien mit 0% (v / v) O2 (Medium, ergänzt mit 10 g/l Na2SO3, das den gesamten gelösten Sauerstoff reduziert) und mit Umgebungsluft gesättigtem Medium durchgeführt. Die Kalibrierungswerte wurden unter Verwendung des PreSens Oxygen Calculators von % Luftsättigung in Torr umgewandelt. Automatisierte Zeitreihenaufzeichnungen und Auswertungen der O2-Bilder wurden in der VisiSens ScientifiCal 1 Software durchgeführt.
Ergebnisse
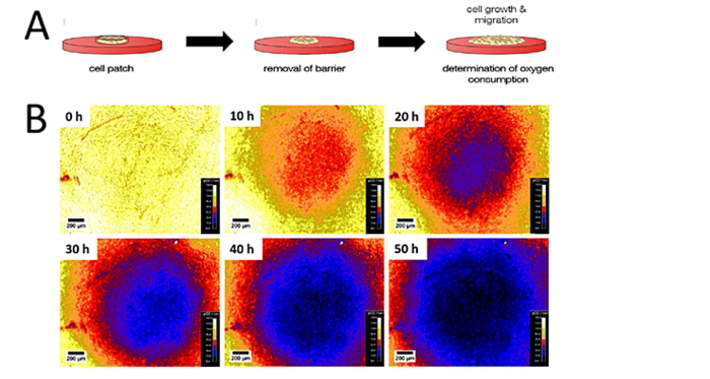
Anhaftende Zellen, die eine Fläche in der Mitte der Sensorfolie bildeten, konnten frei wandern und sich ausbreiten, nachdem die räumliche Barriere entfernt worden war. Gleichzeitig wurde das O2 Imaging gestartet und die zeitlichen und räumlichen O2-Veränderungen während der Migration überwacht (Abb. 2A). Abb. 2B zeigt typische Daten von einem einzelnen Zellfeld als Funktion der Zeit für einen Beobachtungszeitraum von 50 Stunden. Es wurden vier unabhängige Patches untersucht, die ähnliche Ergebnisse ergaben. Die Pseudofarben-O2-Bilder in 2B zeigen die Bildung eines O2-Gradienten mit niedrigeren O2-Konzentrationen in der Mitte des Feldes, verursacht durch Zellatmung. Die Zellen in der Mitte sind von anderen atmenden Zellen umgeben, so dass kein radialer Sauerstoffzufluss erfolgt. Zellen in der Peripherie sind von Medium umgeben, so dass der verbrauchte Sauerstoff zusätzlich durch laterale Diffusion von der Peripherie und nicht nur durch Sauerstoffdiffusion von Flüssigkeitsschichten über den Zellen wieder aufgefüllt wird. Nach 10 Stunden ist die leichte Hypoxie, die durch das aktiv atmende Zellfeld verursacht wird, deutlich sichtbar. Innerhalb der nächsten 10 Stunden nahm die Steilheit des O2-Gradienten zwischen den Zellen und dem peripheren Medium weiter zu, was zu einer hypoxischen zentralen Patch-Region führte. Die Größe des hypoxischen Bereichs nahm während der Messung zu, da sich das Zellpflaster aufgrund von Zellmigration und -proliferation ausdehnte.
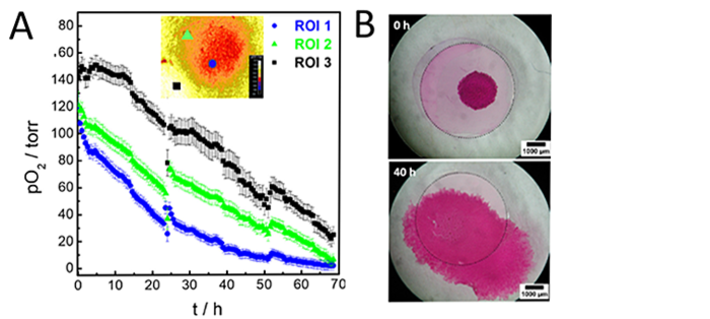
Der zeitliche Verlauf der O2-Abnahme in einem bestimmten ROI (Region of Interest) hängt von seiner Position relativ zu der von der Zellschicht bedeckten Fläche ab. Abb. 3A zeigt drei ausgewählte ROIs (jeweils 85 × 80 px) von einer unterschiedlichen Position des anfänglichen Zellfeldes (ROI 1: Zentrum des Zellfeldes, ROI 2: Randbereich des Zellfelds) oder vom anfänglich zellfreien O2-Sensorbereich (ROI 3). pO2-Werte des anfänglich zellbedeckten Bereichs können leicht von Werten unterschieden werden, die für die anfänglich zellfreie Sensoroberfläche bestimmt wurden. Die pO2-Werte bei t = 0 Std. reichen von anoxischen Werten von (142 ± 10) Torr für ROI 3 bis zu geringfügig niedrigeren pO2-Werten von (119 ± 9) Torr für ROI 1 und (121 ± 10) Torr für ROI 2. Aufgrund des zellulären O2-Verbrauchs sanken die O2-Spiegel in der Mitte des Zellfeldes (ROI 1) innerhalb von 40 Std. um etwa 90 % auf (14 ± 4) Torr und erreichten nach 69 Std. Imaging (1 ± 3) Torr. Am Rand des MDCK II-Feldes (ROI 2) fielen die O2-Werte nach 40 Std. Imaging um etwa 65 % auf einen Wert von (44 ± 6) Torr und erreichten schließlich pO2-Werte von (7 ± 4) Torr. Dieses Ergebnis ähnelt dem ROI 1, was darauf hinweist, dass während der Messung Zellen über die Sensoroberfläche gewachsen und gewandert sind, sodass sich das ROI 2 nicht mehr im Randbereich des Feldes, sondern in der Mitte befindet. Dieser Trend zeigt sich auch an der zunächst zellfreien Sensorstelle (ROI 3). O2 bleibt nicht bei den anfänglichen normoxischen Werten und beginnt nach ca. 15 Std. stark abzufallen, zunächst aufgrund einer Diffusionsverarmung im Medium und anschließend aufgrund der Bedeckung durch atmende Zellen und deren Mikroumgebung. Die O2-Spiegel wurden bei t = 40 Std. auf (77 ± 10) Torr quantifiziert und fielen nach 69 Std. Imaging weiter auf (25 ± 6) Torr ab.
Da die Zellen auf der opaken Sensorfolie durch Phasenkontrastmikroskopie nicht direkt zugänglich sind, wurde das Wachstum und die Migration von MDCK II durch Anfärben der Zellen mit Carbolfuchsin dokumentiert. Die gefärbte Probe wurde durch Stereomikroskopie analysiert. Abbildung 2B zeigt die gefärbten Zellen unmittelbar nach dem Entfernen der Barriere bei t = 0 Std. und nach 40 Std. Imaging. Die anfängliche Größe der Fläche betrug etwa 3,3 mm2 und stieg bei t = 40 Std. etwa 8-fach auf 27,3 mm2 an. Die Zellen verteilten sich während der experimentellen Beobachtungszeit von 40 Std. sowohl auf der O2-Sensorfolie als auch auf der Petrischale.
Diskussion & Zusammenfassung
Das VisiSens TD MIC-System ermöglicht die quantitative Abbildung der zeitlichen und räumlichen Änderungen des O2-Verbrauchs anhaftender Zellmonoschichten in Echtzeit. Unsere Studie zeigt, dass die O2-Niveaus in der direkten Mikroumgebung unter den Zellen, die auf der Sensorfolie wachsen, bestimmt werden. Da (I) der Abstand zwischen Plasmamembran und Sensorfolie in der Größenordnung von 100 nm liegt und (II) die Plasmamembran für molekularen Sauerstoff hoch durchlässig ist, spiegeln die vom Sensor angegebenen Sauerstoffwerte die Sauerstoffwerte im Zytoplasma wider. An verschiedenen Stellen der wachsenden Zellmonoschicht werden starke räumliche und zeitliche Änderungen des Sauerstoffgehalts beobachtet, was darauf hinweist, dass die Zellen innerhalb einer nachwachsenden Zellschicht abhängig von ihrer Position in der Zellschicht sehr unterschiedliche Stoffwechselsituationen (aerob oder anaerob) erfahren. Diese lokal unterschiedlichen Sauerstoffniveaus können eine Quelle für Heterogenität sein, die häufig in Zellpopulationen beobachtet wird, die nominell unter genau den gleichen Kulturbedingungen kultiviert wurden. Mit den VisiSens TD MIC-Systemen können lokale Unterschiede in der Stoffwechselleistung und alle daraus abgeleiteten Konsequenzen bewertet werden.