Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Anwendung des SFR Shake Flask Readers bei Lehrveranstaltungen an der Hochschule Esslingen
Nicht-invasive Messungen von gelöstem Sauerstoff und pH in Schüttelkolben im Rahmen von praktischen Kursen und Studentenprojekten

A. Komitakis, K. Schatz, M. Hoß, R. Biener
Abteilung Biotechnologie, Hochschule Esslingen, Deutschland
Gelöster Sauerstoff (DO) und der pH-Wert sind Schlüsselparameter für mikrobielle Fermentationen und Zellkulturen. Die Bedeutung von DO und pH für Bioprozesse, sowie Methoden um diese zu messen, werden in unserem Bachelor (B. Sc. Biotechnologie) und Master-Programm (M. Eng. Bioverfahrenstechnik) vermittelt. In Vorlesungen zu Messung und Kontrolle lernen die Studenten unter anderem Messprinzipien und die Anwendungen von Clark-Elektroden, optischen Sauerstoffsensoren, und pH-Sensoren kennen. Die Studenten benutzen solche Sensoren dann in Laborkursen und Projektarbeiten zur Überwachung und Steuerung der jeweiligen Parameter in Bioreaktoren. In Vorkulturen oder kleinen Kultivierungen, die hauptsächlich in Schüttelkolben durchgeführt werden, konnten DO und pH bisher jedoch nicht online überwacht werden. Während Proben für eine offline pH-Messung entnommen werden konnten, gab es keine praktische Möglichkeit, den DO in Schüttelkolben zu messen. Daher waren Kulturen oft sauerstofflimitiert, was zu verringerter Produktivität, verringertem Wachstum oder sogar zum Zelltod führte.
Mit dem PreSens SFR Shake Flask Reader können wir DO auch in Schüttelkolben mit Größen zwischen 100 und 1000 ml messen. Da bis zu neun Kolben gleichzeitig überwacht werden können, können viele Experimente parallel durchgeführt werden. Im Master-Laborkurs "prokaryotische Bioprozesse" wird der SFR zur Optimierung von Vorkulturen für Corynebacterium glutamicum eingesetzt. Die Studenten lernen die Auswirkungen verschiedener Faktoren kennen, die das Zellwachstum beeinflussen, indem sie beispielsweise die Geometrie, das Füllvolumen und die Schüttelfrequenz der Kolben variieren. Darüber hinaus wird der Einfluss verschiedener Kolbenverschlüsse und Antischaummittel auf das Zellwachstum getestet. Der SFR wird auch im Rahmen von studentischen Projektarbeiten angewendet, bei denen Studenten selbstständig eine wissenschaftliche Frage untersuchen sollen, z. B. die kLa-Quantifizierung in Schüttelkolben unter verschiedenen Bedingungen, die Optimierung von Wachstumsmedien oder die Produktion von rekombinanten Proteinen.
Material & Methoden
Zur Optimierung der Vorkultur eines Pipecolsäure-produzierenden C. glutamicum Stammes untersuchten die Studenten den Einfluss des Füllvolumens (15 % und 20 %), der Schüttelfrequenz (130 U/min und 150 U/min), der Kolbenverschlüsse (Aluminiumkappen und Silikonschwammfilter) und die Zugabe eines Antischaummittels. Kultivierungen wurden mit CgXII-Minimalmedium, das 20 g/l Glucose enthielt, in 500 ml Schott Duran-Glasschüttelkolben mit vier Schikanen (siehe Abb. 2) bei 30 °C durchgeführt. DO in % Luftsättigung wurde mit dem SFR und integrierten autoklavierbaren Sensor Spots im Abstand von 1 min gemessen. Zusätzlich wurde das Zelltrockengewicht und die Glucosekonzentration nach 22 Stunden Kultivierung bestimmt. Jeder Ansatz wurde doppelt ausgeführt. Für dieses Experiment wurde keine statistische Analyse durchgeführt, aber die gemessenen Kurven schienen keine signifikanten Abweichungen zu zeigen. Aus Gründen der Vereinfachung werden im folgenden die DO-Werte von nur einem Kolben jeder Doppelbestimmung gezeigt.
Ergebnisse eines Studentenprojektes zur Optimierung von Vorkulturen
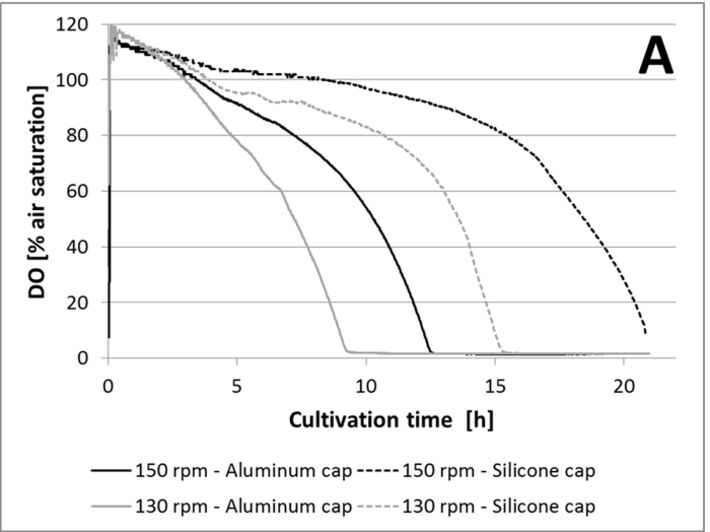
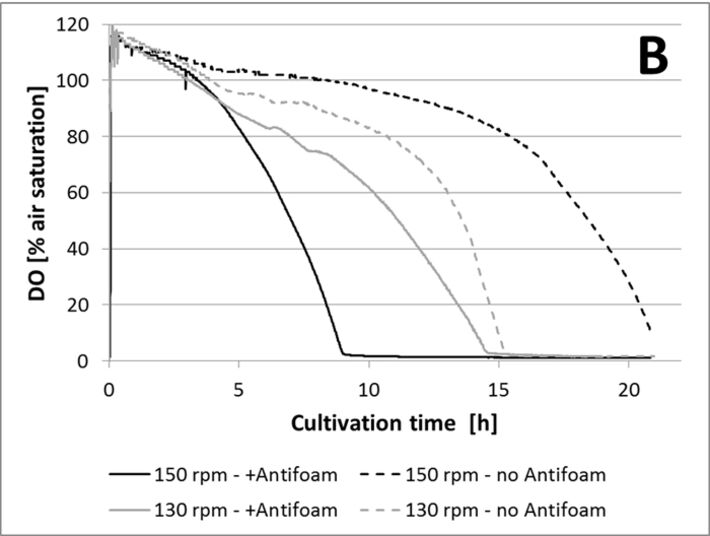
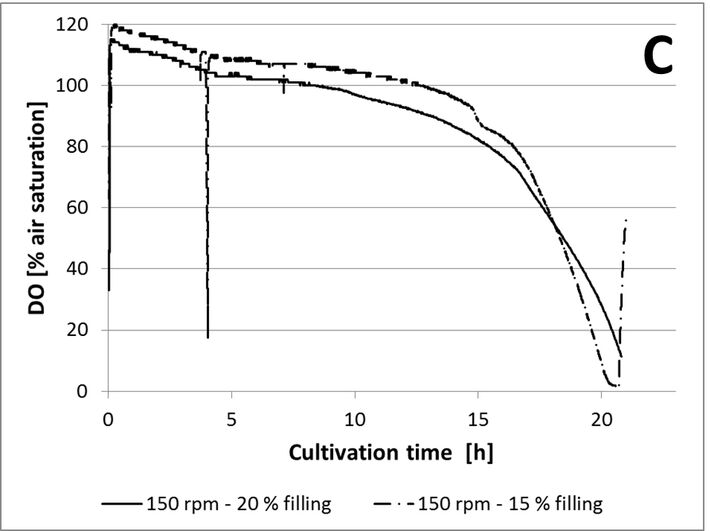
Für den ersten Test wurde das Füllvolumen konstant bei 20 % gehalten und kein Antischaummittel zugegeben. Schüttelkolben wurden bei 150 und 130 U/min inkubiert, jeweils mit Aluminium- oder Silikonkappen. Wie in Abbildung 3A gezeigt ist, führte ein Schütteln bei 150 U/min zu einer höheren Sauerstofftransferrate aus dem Kopfraum in das Medium, als Schütteln bei 130 U/min. Während Kulturen mit Aluminiumkappen bereits nach 12 Stunden sauerstofflimitiert waren, verblieben Kulturen mit Silikonkappen bei 150 U/ min bis zu 21 Stunden in aerobem Zustand. Die Zugabe eines Antischaummittels zu Kulturen mit Silikonkappen verringerte den Sauerstofftransfer beträchtlich, wie in Abbildung 3B gezeigt ist. In der Literatur wurde beschrieben, dass Antischaummittel den kLa reduzieren kann. Antischaummittel verbessern die Koaleszenz von Blasen und erhöhen die Blasengröße, was zu einer Verringerung der spezifischen Oberfläche führt und daher den kLa senkt. Ein anderer Grund könnte sein, dass wegen des Antischaummittels die Kulturbrühe an den oberen Teil des Kolbens spritzte und die Silikonmembran benetzte, die dadurch wahrscheinlich für Sauerstoff weniger permeabel wurde. Der letzte Test zeigte, dass das Füllvolumen keinen signifikanten Einfluss auf den Sauerstofftransfer in den verwendeten Kolben hatte (Abb. 3C). In den Kursen konnten jedoch nicht alle Fragen im Detail analysiert werden. Anhand dieser Ergebnisse ermittelten die Studenten die optimalen Bedingungen (15 % Füllvolumen, Verwendung von Silikonkappen, Schüttelfrequenz von 150 U/min und Inkubationszeiten zwischen 18 und 20 Stunden), um hohe Zellkonzentrationen zu erhalten und Sauerstofflimitierungen zu vermeiden bevor Glukose vollständig verbraucht ist.
Unsere Erfahrung mit dem SFR
Der SFR erwies sich als ideales Werkzeug zur Sauerstoffüberwachung in Schüttelkolben. Da fast keine Vorbereitungszeit benötigt wird und viele Schüttelkolben parallel analysiert werden können, ist der SFR optimal für Anwendungen in unseren Laborkursen geeignet. Die Studenten verstanden sofort die einfache Handhabung und Kontrolle. Der Kursleiter Prof. Dr.-Ing. Richard Biener, lobte auch die möglichen Anwendungen. "Das intuitive Bedienkonzept des SFR-Systems eignet sich für eine Vielzahl von Anwendungen in Forschung und Lehre. Das System ermöglicht eine systematische Optimierung der Kultivierungsbedingungen in Schüttelkolben."



