Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Charakterisierung mikrobieller Wachstumsprofile
Online-Messung von Sauerstoff und pH in Schüttelkolbenkultur
Konstantin Schneider1, Verena Schütz1, Gernot Thomas John2 und Elmar Heinzle1
1Biochemical Engineering Institut, Universität des Saarlandes, 66123 Saarbrücken, Deutschland
2PreSens Precision Sensing GmbH, 93053 Regensburg, Deutschland
Schüttelkolben sind die am häufigsten verwendeten Kultivierungssysteme für die Prozess- und Medienoptimierung, das Screening nach neuen Produkten und Stämmen, sowie für die Bereitstellung von Inokulum für Bioreaktor-Kultivierung. Sauerstofflimitierung ist eines der bedeutendsten, wenn auch oft vernachlässigten Probleme in aeroben Schüttelkolbenkulturen. Die neue Technologie des SFR Shake Flask Readers ist ein ideales Werkzeug zur nicht-invasiven Überwachung der beiden Kulturparameter Sauerstoff und pH, und zeigt zusätzlich ein detailliertes Bild von Wachstumsleistung und Profilen.
Um reproduzierbare aerobe Kultivierungen zu gewährleisten, muss eine Sauerstofflimitierung vermieden werden, da diese zu signifikanten Veränderungen des zentralen Stoffwechsels führen würde. In ähnlicher Weise würden auch pH-Änderungen den Zellstoffwechsel beeinflussen. Obwohl eine Reihe von Studien durchgeführt wurde, um den Sauerstofftransfer in Schüttelkolben zu charakterisieren, führen verschiedene Faktoren, die sehr schwer vorhersehbar sind, zu Veränderungen im Sauerstoff-Massentransfer. Zu diesen Faktoren zählen z. B. die Geometrie üblicherweise von Hand gefertigter Schikanen und die Produktion oberflächenaktiver Verbindungen. Die Online-Überwachung der gelösten Sauerstoffkonzentration (DO) und des pH-Werts würde auch die Kontrolle dieser allgemein wichtigen Parameter in Schüttelkolben ermöglichen. Wir nutzen das SFR (www.presens.de/SFR) für unsere Untersuchungen. Dieses Gerät kann parallel in bis zu neun Schüttelkolben mit entsprechenden Sensoren den pH und DO online messen. Es kann direkt in herkömmlichen Schüttlern eingesetzt werden und überträgt die Daten via Bluetooth, also ohne Kabel, auf einen PC.
Reproduzierbarkeitstests währen der Kultivierung von E. coli
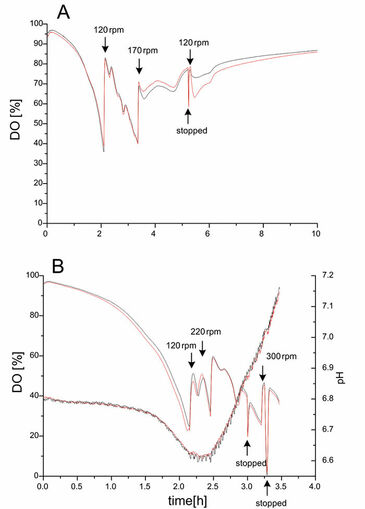
Um die Reproduzierbarkeit des opto-sensorischen Messsystems zu testen, wurde E.coli in Glaskkolben mit Schikanen und Kunststofflkolben ohne Schikanen mit einem Sauerstoffsensor und im Fall des Plastikkolbens mit einem zusätzlichen pH-Sensor kultiviert. In beiden Fällen wählten wir Schüttelkolben mit ähnlichen kLa-Werten. Die Kultivierungen wurden in Duplikaten bei 37 ºC und einer anfänglichen Schüttelfrequenz von 90 U/min durchgeführt. Während der Kultivierung von E.coli DH5a in Glasschüttelkolben konnte nach Inokulation mit einer optischen Dichte (OD 600 nm) von 0.1 ein beschleunigter Abfall des DO beobachtet werden (Abb. 1A). Nach 2 h Kultivierung wurde die Schüttelgeschwindigkeit auf 120 U/min erhöht, um eine Sauerstofflimitierung der Kultur zu vermeiden. Nach 5,5 h erhöhten wir die Schüttelrate nochmals auf 170 U/min. Im ersten Teil von 0 bis 2 h konnte exponentielles Wachstum beobachtet werden, gefolgt von einer zweiten Phase, in der verschiedene Substrate, die in dem verwendeten LB-Medium verfügbar waren, verbraucht wurden. Eine Umstellung des Zellstoffwechsels konnte zwischen 2 und 5 h beobachtet werden, wo die DO-Konzentrationen einige deutliche Peaks zeigen. Nach 5 h wurde die Schüttelfrequenz auf 120 U/min zurückgesetzt. Wegen der allmählich abnehmenden Atmungsaktivität der Kultur stieg der DO langsam an. Die Profile von DO und pH der E. coli DH5a Kultivierung in Kolben ohne Schikanen sind in 1B gezeigt. Es ist offensichtlich, dass diese Kolben für die aerobe Kultivierung von schnell wachsenden E. coli nicht so gut geeignet waren, weil die Sauerstoffversorgung nicht ausreichend war.
Stoffwechselvorgänge während der Kultivierung von C. glutamicum
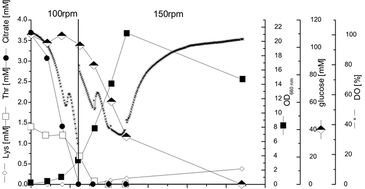
Die Kultivierung von C. glutamicum wurde in Schikanekolben von 250 ml, die mit einem Sauerstoffsensor ausgestattet waren, bei 30 °C und einer Schüttelfrequenz von 100 U/min durchgeführt. Die Mittelwerte von Duplikaten sind in Abb. 2 gezeigt. Sauerstoffverbrauch, Wachstum, Aufnahme von Glucose, Threonin und Citrat sowie Lysinproduktion wurden überwacht (Abb. 2). Zur Untersuchung der Reproduzierbarkeit der Messungen wurden Schüttelkolben mit ähnlichen kLa-Werten für parallele Experimente verwendet. Die resultierenden Standardabweichungen des DO lagen unter 3 %, was die hohe Reproduzierbarkeit der Kulturen und der Messung bestätigt. Die Kultivierung zeigte ein typisches Zweiphasenprofil einer Diauxie, wobei zuerst Citrat und dann Glucose als Hauptkohlenstoffquellen verbraucht wurden. Die Verschiebung des Metabolismus von Citrat zu Glucose als Kohlenstoffquelle konnte durch den kurzen Anstieg der DO-Konzentration präzise bestimmt werden. Nach 5,5 h wurde die Schüttelfrequenz aufgrund des hohen Sauerstoffbedarfs wieder auf 150 U/min erhöht.
Minimierung des Pufferbedarfs durch Online pH-Messungen
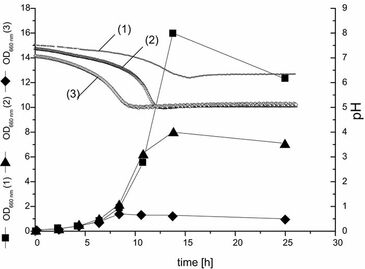
Bei der Medienoptimierung, insbesondere für die industrielle Produktion, ist es zwingend erforderlich, den minimalen Pufferbedarf für einen Organismus zu ermitteln. Als Beispiel wurde C. glutamicum lysCfbr in einem definierten Medium mit verschiedenen Phosphatpufferkonzentrationen gezüchtet und der pH online überwacht. Die Kultivierung wurde unter Verwendung von 250 ml Schüttelkolben ohne Schikanen durchgeführt, die mit einem pH- und einem Sauerstoffsensor ausgestattet waren. Kultivierungsprofile sind in Abb. 3 gezeigt. Phosphatkonzentrationen von 32 mM und 6 mM waren eindeutig limitierend, wie die OD- und DO-Kurven in Abb. 3 zeigen.
Zusammenfassung
Das neue SFR System ermöglicht genaue DO- und pH-Messungen in Schüttelkolbenkulturen und verbessert somit erheblich die Qualität und Zuverlässigkeit von Kultivierungen. Da die gemessenen Daten online verfügbar sind, könnte DO mit Gemischen aus Luft, Sauerstoff und Stickstoff gesteuert werden. Der pH-Wert könnte durch die automatische Zugabe von Base oder Säure kontrolliert werden. Wenn der kLa ermittelt wird, kann die Sauerstoffaufnahmerate online, während der Kultivierung bestimmt werden. Ein großer Vorteil ist die sofortige Visualisierung von Substrat- oder Sauerstofflimitierungen der Kultur, was bei der Verwendung von Schüttelkolben als Screening-Vorrichtung für aerobe Prozesse entscheidend ist. Die DO-Messung erlaubt auch eine Online-Anzeige von Diauxie-Effekten. Die Online-Überwachung von DO beseitigt natürlich nicht die begrenzte Sauerstoffübertragung in Schüttelkolben, aber ermöglicht es zu kontrollieren, ob Sauerstoff limitierend wird oder nicht. Viele quantitative Studien in der Systembiologie werden in Schüttelkolben anstelle von Bioreaktoren durchgeführt. Da Schüttelkolben normalerweise geringere Sauerstofftransferraten als gerührte Bioreaktoren haben, ist es noch wichtiger, die Sauerstoffkonzentration während, z. B. der Untersuchung von Mutanten, zu überwachen, um unentdeckte Limitierungen zu vermeiden, die in solchen Studien große systematische Verzerrungen und biologische Fehlinterpretationen verursachen können.
Applikationsbericht nach
Schneider et al., 2009, Optical device for parallel online measurement of dissolved oxygen and pH in shake flask cultures. Bioprocess Biosyst Eng DOI 10.1007/s00449-009-0367-0


