Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Entwicklung einer biomimetischen Lung-on-a-Chip Plattform
Sauerstofftransfer-Messungen mit SensorPlugs am Einlass und Auslass
Daniel Cheng, Charles Klassen, Harald C. Ott
IVIVA Medical, Beverly, MA, USA
Ziel dieses Projekts war es, eine biomimetische Lung-on-a-Chip Plattform für das Tissue Engineering und speziell für Untersuchungen zur Krankheitspathologie bereitzustellen. Wir haben zuerst eine Langzeitkultur in einem 3D-Lungenmodell etabliert und die Basiswerte für den Sauerstofftransfer und die Flüssigkeitsfiltration durch die poröse Membran in unserem Modell gemessen, von denen bekannt ist, dass beide in vivo von einer Virusinfektion beeinflußt werden. Zur Messung des Sauerstofftransfers verwendeten wir die optischen Sauerstoffsensoren von PreSens, die sowohl am Einlass als auch am Auslass unseres Gerüsts direkt im Flüssigkeitsperfusionspfad platziert waren. Mit diesem Aufbau konnten wir zeigen, dass unser Lung-on-a-Chip Modell ähnliche, auf die Gasaustauschoberfläche normalisierte Sauerstoffübertragungsraten erzielt, wie dies bei kommerziellen Oxygenatoren der Fall ist.
Die aktuelle COVID-19-Pandemie unterstreicht die Notwendigkeit einer universell verfügbaren, einfachen, erschwinglichen, skalierbaren und physiologisch relevanten Plattform, um die Auswirkungen einer Virusinfektion auf die menschliche Lunge zu untersuchen. Es gibt zunehmend Hinweise darauf, dass eine aberrante und maladaptive Immunantwort und nicht die Virusreplikation zu einer akuten Lungenverletzung bei Patienten mit schwerem Krankheitsverlauf beiträgt. Angesichts der Heterogenität der klinischen Ergebnisse ist es möglich, dass einige Patienten eine schützende Immunantwort entwickeln, andere dagegen eine schädliche. Daher muss jede mögliche Therapie zur Abschwächung der durch das Immunsystem verursachten Verletzungen individualisiert werden. Um die Immunantwort auf SARS-CoV-2 zu verstehen und zu modulieren, ist eine schnelle Screening-Testplattform erforderlich, mit der die Wechselwirkung zwischen dem Virus und der Immunantwort sowie deren Auswirkungen auf die Lungenarchitektur und -funktion zuverlässig modelliert werden kann.
Bisher gibt es keine Modelle, die die Funktionseinheit des distalen Lungengewebes genau nachstellen können. Bereits existierende Lung-on-a-Chip-Modelle enthalten mikrofluidische Kanalnetzwerke, die in ein nicht biologisches Material wie Polydimethylsiloxan (PDMS) eingebettet sind, und können Wechselwirkungen zwischen Zelle und extrazellulärer Matrix, physiologische Flussprofile, interstitielle Flüssigkeitsverschiebungen und Sauerstoffübertragung möglicherweise nicht genau so nachstellen, wie sie in nativem Gewebe vorkommen. Darüber hinaus neigen nicht-biologische Materialien zu Thrombosenbildung und Fäulnis und sind daher möglicherweise nicht wirksam bei der Untersuchung von Krankheitserregern mit langen Inkubationszeiten die mehrere Tage oder Wochen Kultivierung erfordern.
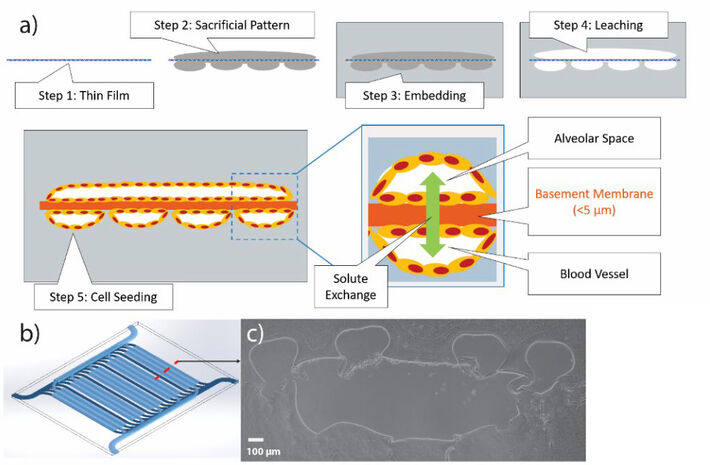
Bei IVIVA haben wir verschiedene Technologien eingesetzt, darunter 3D-Druck und Herstellung dünner Filmmembranen, um ein vollständig biologisches Gerüst mit eingebetteten Gefäß- und Atemwegsnetzwerken zu entwickeln, die durch eine dünne (ca. 5 µm) poröse Gelatinemembran getrennt sind. Zellen können auf gegenüberliegenden Seiten der Membran ausgesät und in einer Luft-Flüssigkeits-Grenzflächenkultur gehalten werden. In vorangegangenen Experimenten haben wir die Transplantation verschiedener Zellen in unsere 3D-Gerüste bestätigt und die Kultur über 21 Tage aufrechterhalten. Wir nehmen an, dass ein physiologisch relevantes biologisches Gerüst die Untersuchung der direkten Auswirkungen von Virusinfektionen auf das Lungengewebe sowie die immunologischen Folgen und die Bewertung therapeutischer Interventionen ermöglicht. Eine der wichtigsten funktionellen Metriken zur Bewertung des funktionellen Lungengewebes ist der Sauerstofftransfer von den Atemwegen in die vaskuläre Blutversorgung.
Unser erstes Ziel war es, unser Lung-on-a-Chip-Modell zu entwickeln und funktionelle Basismetriken für den Sauerstofftransfer und die Flüssigkeitsfiltration in einem azellulären Modell festzulegen. Diese Messungen werden als nächstes in unseren Scaffolds wiederholt, die mit Endothelzellen und Alveolarepithelzellen im Gefäß- bzw. Atemwegskompartiment besiedelt wurden. Indem wir zuerst die funktionellen Basismessungen für den Sauerstofftransfer in einem azellulären Gerüst festlegen, können wir dann die Auswirkungen von Zellen messen und mit bekannten physiologischen Werten vergleichen. Wir werden dann eine gut charakterisierende Störung in das System einführen, das bakterielle Lipopolysaccharid (LPS), und seine Auswirkungen auf den Gastransfer messen, um unser Modell zu validieren.
Material & Methoden
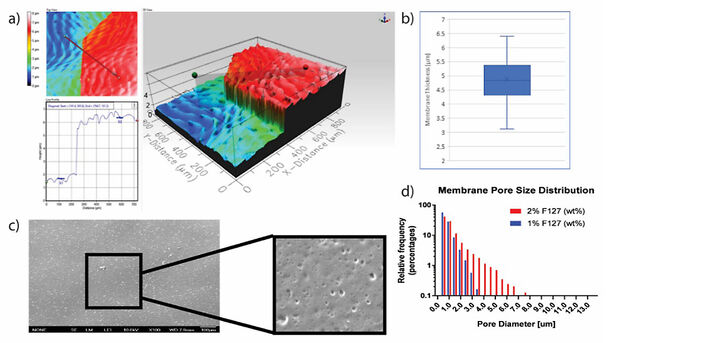
Zuerst haben wir Basalmembranen definierter Zusammensetzung mit einer kontrollierten Dicke von ca. 5 µm (ABB. 1a, b) hergestellt. Unter Verwendung von F127 als Opferporogen erzeugten wir Poren von 0,1 bis 4 µm, ähnlich denen, in der menschlichen Bronchialbasalmembran (Fig. 1c, d).
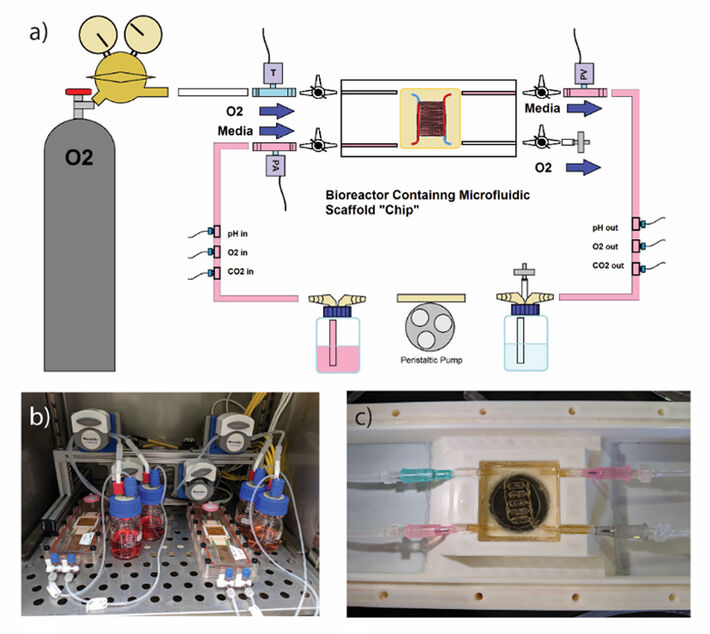
Dann wurden die Kanäle mit Opfergel-Tinte (Pluronic F127) auf beide Seiten der Membran in 3D gedruckt. Gelatine wurde unter Verwendung von 3D-gedruckten Kunststoffformen auf diese Membranen gegossen und unter Verwendung von mikrobieller Transglutaminase vernetzt, bevor die Opferkanalmuster ausgewaschen wurden. Nach der Evakuierung des F127 verbleiben Hohlkanalnetze, die direkt mit dem Durchfluss verbunden werden können, von einer Schlauchpumpe angetrieben und mit Flüssigkeit oder Luft durchströmt. Die hohlen Kanäle können auch mit Zellen besät werden, die an den Gelatinekanalwänden haften und eine Zellmonoschicht bilden (Abb. 2a). Unsere Kanalgeometrie wurde mit einem 1000 µm breiten Alveolarraum neben kleineren 200 µm Gefäßkanälen entworfen (Abb. 2b). Die Alveolaroberfläche beträgt 232 mm2 und die Gefäßoberfläche 184 mm2, ein Verhältnis von 1,26 (Abb. 2c). Um eine Luft-Flüssigkeits-Grenzflächenkultur (ALI) für dieses Projekt zu etablieren, haben wir Luft mit einer peristaltischen Pumpe durch das Atemwegskanalnetz perfundiert, wobei die Durchflussraten mithilfe einer in LabView entwickelten benutzerdefinierten Software gesteuert wurden. PreSens O2 SensorPlugs (zusammen mit pH- und CO2-SensorPlugs) wurden sowohl am Einlass als auch am Auslass des Gerüsts im Fluidweg positioniert, wobei kontinuierlich Flüssigkeit durch das Gefäßnetzwerk perfundierte. Es gab auch Inline-Drucksensoren für den Luftröhreneinlass (T), den Lungenarterieneinlass (PA) und den Lungenvenenauslass (PV) (Abb. 3a). Wir perfundierten 100% O2 durch das Atemwegsnetz und maßen die O2-Übertragungsrate von den Luftkanälen über die Membran in das Gefäßnetz, indem wir die O2-Konzentration am Auslass von der Einlasskonzentration subtrahierten, sobald das System bei einer bestimmten Flüssigkeits- und Gasflussrate das Gleichgewicht erreicht hatte.
Ergebnisse
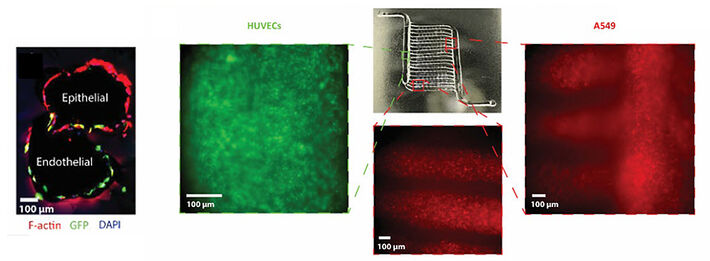
Die mechanische und biochemische Umgebung der Lunge hat großen Einfluss auf die Zellfunktion. Bestehende In-vitro-Modelle rekapitulieren jedoch häufig die Physiologie nicht genau und enthalten häufig synthetische Materialien. Um diesen Herausforderungen zu begegnen, haben wir ein vollständig biologisches Modell entwickelt, das auf einer neuartigen Methode zur Erzeugung von 3D-Kanalnetzwerken basiert, die von Basalmembranen ausgekleidet sind. Wir haben die erzeugten Gerüste, die mit Epithelzellen (A549) und Endothelzellen (HUVEC) besiedelt wurden, bis zu 16 Tage lang in Perfusionsbioreaktoren mit konstanter Medienperfusions erfolgreich kultiviert (Abb. 4).
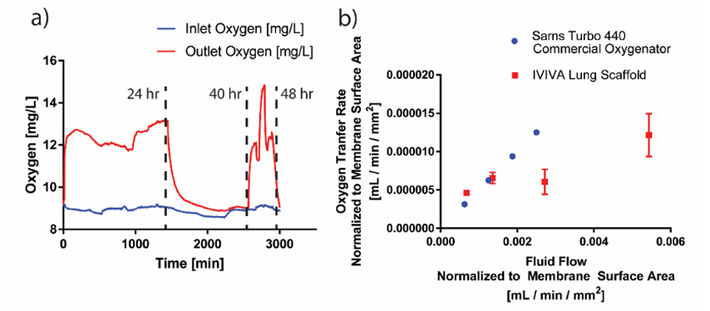
Wir haben die O2 Diffusion und den Flüssigkeitstransfer in unseren Gerüsten gemessen und die strukturelle Integrität des Gerüsts nach 72-stündiger Perfusion mit 100 % O2 und PBS bei physiologischem Druck bestätigt. Abbildung 5a zeigt die Messung der Sauerstoffkonzentration in einem Gerüst über einen Zeitraum von 48 Stunden unter Verwendung von PreSens Sauerstoffsensoren sowohl am Einlass als auch am Auslass des Gefäßkanalnetzwerks. Der gesamte Sauerstofftransfer durch unser Gerüst ist definiert als Flüssigkeitsdurchfluss x (Ausgangs-O2-Gehalt - Eingangs-O2-Gehalt). Die Medienflussrate in den Kanälen wurde variiert, was die O2 Konzentration im Laufe der Zeit beeinflusste. Nach 24 h O2 Perfusion wurde die O2-Einströmung über Nacht auf 4 mmHg Druck verringert und am nächsten Tag nach 40 h wieder gestartet. Nach 48 Stunden wurde der O2-Fluss gestoppt.
Nach Normalisierung der O2-Diffusionswerte auf die Oberfläche des Gefäßnetzwerks stellten wir fest, dass unsere O2-Übertragungsrate mit einem kommerziellen Oxygenator, dem Sarns Turbo 440, vergleichbar war (Abb. 5b).
Zusammenfassung
Bisher haben wir ein vollständig nicht-synthetisches Lung-on-a-Chip-Modell entwickelt, das für Zellkultur an der Luft-Flüssigkeits-Schnittstelle verwendet werden kann. Wir haben PreSens O2 SensorPlugs verwendet, um den Sauerstofftransfer von einem gasdurchströmten Atemwegskanalnetz in ein flüssigkeitsdurchströmtes Gefäßnetz über eine dünne biologische Membran zu messen, und festgestellt, dass unser Gerüst ähnliche Sauerstoffübertragungsfähigkeiten wie ein kommerzieller Oxygenator aufweist, wenn auf die Oberfläche normalisiert wird. In zukünftigen Studein wird die Wirkung sowohl von Gefäßendothel- als auch von Alveolarepithelzellen, die die Gefäß- bzw. Atemwegsnetzkanäle auskleiden, auf den Sauerstofftransfer gemessen. Wir werden dann unser System mittels der gut etablierten Störung mit bakteriellem LPS validieren, von der bekannt ist, dass sie sich nachteilig auf das Überleben der Zellen und funktionelle Ergebnisse wie Gasaustausch und Flüssigkeitstransfer auswirkt. Nach der Validierung unserer Plattform gehen wir eine Zusammenarbeit mit dem Massachusetts General Hospital (MGH) und einem Labor an der Universität von Kalifornien in San Francisco (UCSF) ein, um die Auswirkungen des SARS-CoV-2-Virus auf das distale Lungengewebe zu untersuchen. Wir werden dies erreichen, indem wir ein pseudotypisiertes Virus, ein virusähnliches Partikel, das mit dem "Spike"-Protein aus dem Coronavirus beschichtet ist, in unser Lungenmodell einführen und dessen Auswirkungen auf funktionelle Ergebnisse wie den Sauerstofftransfer messen. Diese In-vitro-Testplattform ermöglicht eine direkte Beobachtung der Auswirkungen des Virus auf das Lungengewebe sowie die Prüfung potenzieller therapeutischer Interventionen auf menschliche Zellen vor klinischen Studien.
Danksagung:
Diese Arbeit wurde durch Zuschüsse von United Therapeutics und der Mendez National Institute of Transplantation Foundation unterstützt.