Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Wieviel O2 ist wirklich in Ihrer Zellkultur?
Kontinuierliche Bewertung vertikaler O2-Gradienten in statisch anhaftender Zellkultur mit dem VisiSens ™ MIOS-System
L. Sauer1, D. Obermeier2, G. Liebsch2, R. J. Meier2, J. Wegener1,3
1Institut für Analytische Chemie, Chemo- und Biosensorik, Universität Regensburg, Regensburg, Deutschland
2PreSens Precision Sensing GmbH, Regensburg, Deutschland
3Fraunhofer-Einrichtung für Mikrosysteme und Festkörper-Technologien (EMFT), Regensburg, Deutschland
Dieser Applikationsbericht beschreibt eine Methode zur kontinuierlichen nicht-invasiven Messung vertikaler Sauerstoffgradienten (VOGs) in Zellkulturgefäßen unter Verwendung eines Zellkultur-Imaging-Einsatzes namens MIOS (Multiwell Insert Optical Sensor) und der VisiSens ™ Imagingtechnologie. Die Ergebnisse zeigen einen signifikanten Unterschied zwischen "angenommenen" und tatsächlichen Zellkulturbedingungen.
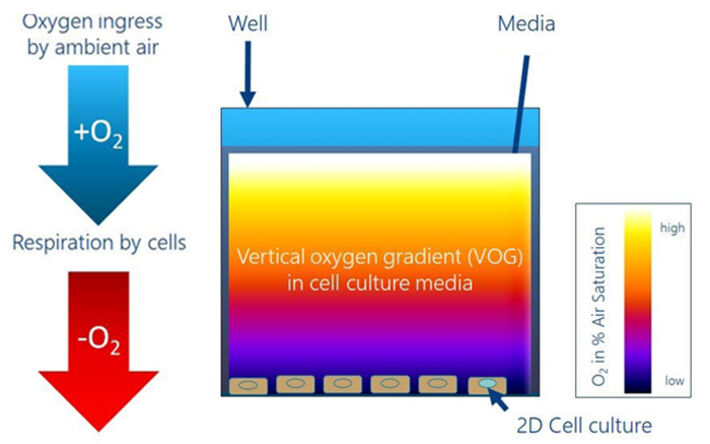
Der Nobelpreis für Medizin 2019 hat alle darauf aufmerksam gemacht, dass Säugetierzellen auf perizelluläre Sauerstoffkonzentrationen mit sehr komplexen, gewebespezifischen und streng kontrollierten Veränderungen der Genexpression reagieren, was zu Veränderungen des Stoffwechsels und anderen Aspekten der Zellphysiologie führt. Die meisten bekannten Fakten über die zelluläre Reaktion auf verschiedene O2-Niveaus wurden aus der Untersuchung von Zellen in Gewebekulturen gewonnen. Anhaftende Zellen werden routinemäßig unter statischen Bedingungen in einem befeuchteten Inkubator mit einer Atmosphäre von 95% Umgebungsluft und 5% CO2 bei 37 ° C gezüchtet. Es ist bekannt, dass die Höhe der Kulturflüssigkeit, die die anhaftenden Zellen bedeckt, entscheidend ist, um eine ausreichend schnelle Diffusion von O2 von der Luft-Flüssigkeits-Grenzfläche zum Boden der Kulturschale zu ermöglichen. Die Details dieses vertikalen Sauerstoffgradienten (VOG) sind jedoch nur wenig bekannt, da er von mehreren Parametern beeinflusst wird: (I) der Respirationsrate der Zellen, (II) der Zellzahl pro Flächeneinheit, (III) der Zusammensetzung des Mediums , da es bestimmt, welche Stoffwechselwege aktiv sind, (IV) das Gesamtvolumen des sauerstoffhaltigen Mediums und (V) die Geschwindigkeit des Eindringens von O2 aus der Atmosphäre in das Medium. Daher ist die Schätzung des VOG von der Luft-Flüssigkeits-Grenzfläche (Quelle) zu den Zellen am Boden der Schale (Senke) (siehe Abb. 1) ein multifaktorielles Problem, das eine experimentelle Bewertung für verschiedene Zellkulturbedingungen und -geometrien erfordert. Detailliertes und zeitaufgelöstes Wissen über diesen Gradienten ermöglicht eine bessere Kontrolle und Standardisierung der O2-Niveaus, mit denen Zellen konfrontiert sind. Es ist offensichtlich, dass Unterschiede in der Sauerstoffversorgung der Zellen eine potenzielle Ursache für eine schlechte Reproduzierbarkeit von Zellexperimenten von Labor zu Labor sein können, da pO2 den Energiestoffwechsel direkt beeinflusst und als starker Hebel für die Genexpression und phänotypische Veränderungen fungiert.
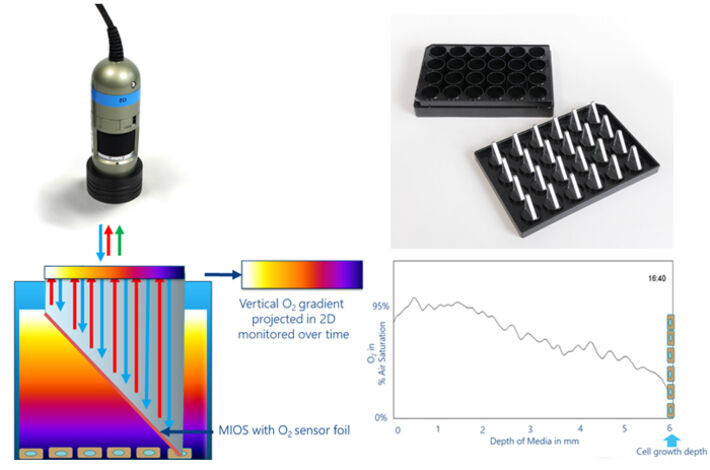
Material & Methoden
Der VOG von der Luft-Flüssigkeits-Grenzfläche zwischen Medium und Atmosphäre zu den anhaftend wachsenden Zellen auf dem Boden einer normalen Zellkulturschale wurde unter Verwendung des VisiSens ™ A1-Sauerstoffbildgebungsaufbaus zusammen mit O2-spezifischen MIOS-Sensoren gemessen (Abb. 2). Das MIOS-System besteht aus einem Halter, der dem Format einer Platte mit 24 Vertiefungen entspricht und bis zu 24 einzelne MIOS enthält, die von oben in die Zellkulturflüssigkeit einer der Vertiefungen eintauchen. Die MIOS-Sensoren sind optische Lichtleiterelemente, wobei der empfindliche Teil wie ein rechtwinkliges Dreieck geformt ist (Abb. 2). Ein Schenkel ist parallel und nahe an der Luft-Flüssigkeits-Grenzfläche und bildet die Ausleseebene, während der andere Schenkel orthogonal zum Boden der Kulturoberfläche ist und in das Medium eintaucht, so dass die Hypothenuse eine schiefe Ebene in der Kulturflüssigkeit bereitstellt. Diese geneigte Seite des "Dreiecks" ist mit einer SF-RPSu4 Sauerstoffsensorfolie beschichtet. Der Sensor steht in allen Höhenstufen von der Zellschicht bis zur Luft-Flüssigkeits-Grenzfläche in direktem Kontakt mit der Kulturflüssigkeit. Wenn der VisiSens ™ -Detektor auf den horizontalen Schenkel des MIOS fokussiert ist, breitet sich das Anregungslicht durch das Lichtleiterelement aus und regt die Lumineszenzfarbstoffe in der Sensorfolie an. Einer der Farbstoffe wird durch Sauerstoff gelöscht, während der andere gegenüber O2 unempfindlich ist und als interne Referenz für die ratiometrische Quantifizierung dient. Die Lumineszenzen aus den verschiedenen Positionen der Sensorfolie (vertikaler Gradient) werden auf den parallel zur Oberfläche verlaufenden MIOS-Schenkel zurückprojiziert und in einen horizontalen Gradienten umgewandelt. Der Gradient wird mit der VisiSens ™ Detektoreinheit abgebildet. Wenn Sie die geometrischen Abmessungen des MIOS-Dreiecks kennen, erhalten Sie eine genau definierte Beziehung, um die x-Position des horizontalen Gradienten in die z-Position des VOG umzuwandeln. So ermöglicht das MIOS die Abbildung von VOGs in 24-Well Platten und ebnet den Weg für systematische Studien darüber, wie unterschiedliche experimentelle Parameter die O2-Verteilung in Zellkulturflüssigkeiten und die Verfügbarkeit von O2 für anhaftende Zellen am Boden der Vertiefung beeinflussen.
In dieser Studie wurde der MIOS-Sensor angewendet, um die VOGs im Medium über konfluenten in vitro Kulturen normaler Rattennierenzellen (NRK) aufzuzeichnen und zu bewerten. Suspendierte NRK-Zellen wurden in einer Zelldichte von 2,5 x 105 Zellen / cm² in eine 24-Well Platte ausgesät. Man ließ die Zellen 48 Stunden lang anhaften und sich ausbreiten. Nach der Vorkultur wurde reguläres Zellkulturmedium durch L-15-Medium ohne Phenolrot ersetzt. Die Zellen wurden dann mit dem MIOS-System bei 5% CO2 und 37 ° C für 24 Stunden überwacht. Die automatisierte Zeitreihenaufzeichnung und Auswertung der O2-Bilder wurde mit der VisiSens AnalytiCal 1 Software durchgeführt, gefolgt von der Datenverarbeitung mit dem ImageJ StackPlotProfile-Plug-In.
Ergebnisse
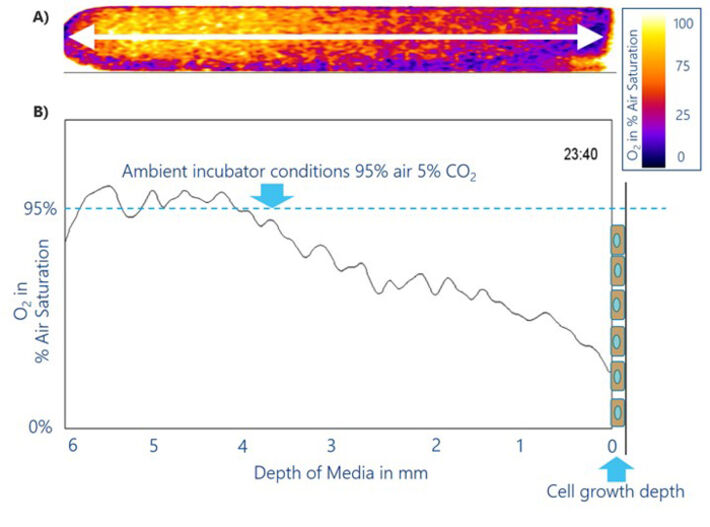
Das MIOS-System wurde in NRK-Zellkulturen mit einer Flüssigkeitshöhe von ca. 6 mm, vom Boden der Kulturschale bis zur Luft-Flüssigkeits-Grenzfläche, angewendet. Das MIOS deckt die volle Flüssigkeitshöhe von 0 bis 6 mm ab und ermöglicht eine kontinuierliche Überwachung des VOG. Abbildung 3A zeigt die Imaging-Daten des im Medium entstandenen VOG in Pseudofarben codiert. Die linke Seite zeigt Bedingungen nahe der Luft-Flüssigkeits-Grenzfläche. In diesen obersten Flüssigkeitsschichten bis zu 2 mm unterhalb der Grenzfläche entspricht die mittlere O2-Sättigung den Inkubatorbedingungen (95 % Luftsättigung). Offensichtlich kompensiert der über die Grenzfläche (1,4 cm2) eindringende Sauerstoff aus der Umgebungsluft die Sauerstoffdiffusion zu den verbrauchenden Zellen. Tief in der Zellkulturflüssigkeit (2 bis 4 mm von der Oberfläche entfernt) wird ein annähernd konstanter Gradient beobachtet. Innerhalb dieser Zone nimmt der Sauerstoffgehalt von 95 % Luftsättigung auf 38 % Luftsättigung in 2 mm Abstand von den Zellen ab. Dieser nahezu lineare Gradient zeigt die zunehmende Sauerstoffabnahme in den verschiedenen Flüssigkeitsschichten, verursacht durch die Atmungsaktivität der Zellen und eine unzureichend schnelle diffusive O2-Zufuhr von der Grenzfläche. In der Flüssigkeitsschicht 1 mm über der Zellschicht fällt der lokale O2-Gehalt auf 20% Luftsättigung nahe an der Zelloberfläche. Es entsteht eine Verarmungszone, und die Zellen am Boden der Schale weisen einen signifikant niedrigeren O2-Gehalt auf, als dies aufgrund des O2-Gehalts in der Inkubatoratmosphäre und der Löslichkeit von O2 in physiologischen Puffern zu erwarten wäre. In Wirklichkeit sind Zellen schweren hypoxischen Bedingungen ausgesetzt, wenn sie in einem normoxischen Inkubator gezüchtet werden. Die damit einhergehenden Veränderungen des Energiestoffwechsels und des funktionellen Zellphänotyps müssen noch untersucht werden, beispielsweise durch systematischen Vergleich von Zellen unter statischen und unter Fließbedingungen.
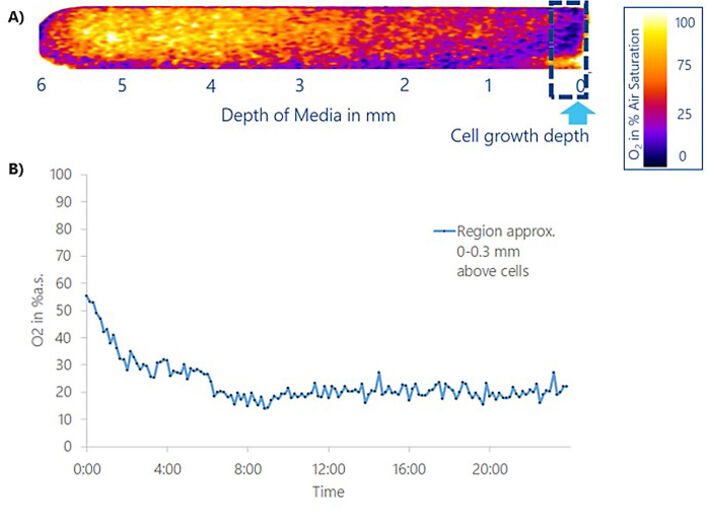
Beim Wechsel von der lokalen zur zeitabhängigen Analyse kann die O2-Konzentration innerhalb von 0,3 mm Mediumhöhe über der Zellschicht (= Volumen von Interesse VOI) im gleichen Experiment 24 Stunden nach dem Mediumaustausch (Abb. 4) quantitativ erfasst werden. Das VOI wurde alle 10 Minuten gemittelt und als Funktion der Zeit aufgetragen (Abb. 4B). In den ersten 6 Stunden nach dem Mediumaustausch nahmen die O2-Werte im VOI von anfänglich 55 % Luftsättigung auf konstante Werte von 20% Luftsättigung ab, was auf hypoxische Zustände nach einer Kulturzeit von nur 6 Std. unter den Bedingungen in diesem Experiment (6 mm Flüssigkeitshöhe) hinweist. Das anfänglich sauerstoffhaltige, frische Medium ist aufgrund der kontinuierlichen Zellatmung und der unzureichenden O2-Eintritts- / Diffusionsrate an O2 abgereichert. 20 % Luftsättigung, der stationäre Zustand nach 6 h, betragen 1,35 mg/l oder 42,1 µmol/l O2 im VOI.
Diskussion & Zusammenfassung
NRK-Zellen wurden unter Bedingungen, die allgemein als "Standardbedingungen" angesehen werden, bei 37 ° C in einem herkömmlichen Inkubator mit stabilen 5 % CO2 in der angefeuchteten Atmosphäre kultiviert. Die verbleibenden 95 % der Inkubatoratmosphäre bestanden aus 20,9 % O2 bei 1020 mbar Umgebungsluftdruck. Somit beträgt der O2-Gehalt unter normoxischen Bedingungen 19,9 % (142,9 Torr) oder in wässrigen Medien (physiologischer Salzgehalt) 6,4 mg/l oder 199,9 mol/l gelösten Sauerstoff. Es wird allgemein angenommen, dass lebende Zellen in Kultur während ihrer gesamten in vitro Lebensdauer diesem pO2 ausgesetzt sind. Da Zellen jedoch O2 mit individuellen Raten verbrauchen und der O2-Eintrag in Zellkulturgefäßen mit unterschiedlichen Geometrien unterschiedlich ist, ist der tatsächliche pO2, dem die Zellen ausgesetzt sind, häufig signifikant unterschiedlich. Dies kann für Unterschiede in der Stoffwechselaktivität oder sogar für funktionelle Phänotypen verantwortlich sein. Dementsprechend ist es für standardisierte und reproduzierbare Zellkulturexperimente obligatorisch, die lokale O2-Verfügbarkeit in einem bestimmten experimentellen Szenario zu kennen und zu kontrollieren. Der vorgestellte MIOS-Sensor hilft dabei, die aktuellen Einschränkungen bei der Beurteilung der lokalen O2-Verfügbarkeit in Kulturen zu überwinden. Zusammen mit dem VisiSens™ Aufbau ermöglicht es die Messung des VOG in Zellkulturflüssigkeiten zwischen der Luft-Flüssigkeits-Grenzfläche und der Zellschicht am Boden von 24-Well Platten. Unsere Studie zeigt deutlich, wie sich die Sauerstoffversorgung im Medium sowohl im vertikalen Profil als auch im Laufe der Zeit ändert. Die Daten belegen quantitativ, dass Zellen, die nominell unter normoxischen Bedingungen kultiviert wurden, in ihrer direkten lokalen Mikroumgebung eine Hypoxie erfahren. Der Grad der O2-Abreicherung im perizellulären Bereich ist multifaktoriell und hängt als solcher von der Flüssigkeitshöhe und der Stoffwechselaktivität der untersuchten Zelle ab. Die MIOS-Technik bietet quantitative Einblicke in die tatsächlichen O2-Niveaus in der zellulären Mikroumgebung, wenn sie unter "standardisierten" Inkubatorbedingungen mit 95 % Luftsättigung kultiviert wird. Es zeigt den Grad der Hypoxie für gegebene experimentelle Einstellungen und kann die Grundlage für eine genauere Standardisierung der Zellkulturbedingungen und eine verbesserte Reproduzierbarkeit von zellbasierten Assays sein.


