Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Hypoxische Präkonditionierung von humanen mesenchymalen Stammzellen
Wiederherstellung des Differenzierungspotentials von hMSCs unter hypoxischen Bedingungen
Elias Volkmer1, Booby Cherian Kallukalam1, Josef Maertz1, Sven Otto2, Inga Drosse1, Hans Polzer1, Wolfgang Bocker1, Michael Stengele1, Denitsa Docheva1, Wolf Mutschler1, und Matthias Schieker1
1Experimental Surgery and Regenerative Medicine, Department of Surgery, LMU München, Deutschland 2Department of Oral and Maxillofacial Surgery, LMU München, Deutschland
In dieser Studie wurde das osteogene Differenzierungspotential von hMSCs unter hypoxischen Bedingungen von 2 % O2 im Vergleich zur Standard-Sauerstoffatmosphäre für Gewebekultur von 21 % untersucht. Weitere Tests wurden durchgeführt, um zu bestimmen, ob eine hypoxische Präkonditionierung Auswirkung auf die folgende osteogene Differenzierung von hMSCs hat und ob diese Vorbehandlung für den Differenzierungsprozess vorteilhaft sein könnte. Es wurde festgestellt, dass sich hMSCs besser vermehren, wenn sie bei 2 % O2 kultiviert werden, jedoch hemmt eine konstante Hypoxie die osteogene Differenzierung. Die hypoxische Präkonditionierung von hMSCs vor der osteogenen Induktion stellt die osteogene Differenzierung der Zellen unter hypoxischen Bedingungen wieder her.
Hypoxie könnte direkt mit der osteogenen Differenzierung von Knochenvorläuferzellen zusammenhängen, da die reduzierte Sauerstoffversorgung nach Knochenbruch den Heilungsprozess auslöst. Die 21 % Sauerstoffatmosphäre, die üblicherweise in Zellkultur verwendet wird, wird eher als ein Zustand von Hyperoxie angesehen und niedrige Sauerstoffspannungen scheinen ein physiologisch besseres Milieu für Stammzellen zu sein. Zellen, die für das Tissue Engineering verwendet und auf einem 3D-Gerüst ausgesät werden, werden aufgrund der ungleichmäßigen Sauerstoffzufuhr entlang des 3D-Konstrukts oft hypoxischen Bedingungen ausgesetzt. Da hMSCs im Tissue Engineering niedrigen Sauerstoffkonzentrationen ausgesetzt sein können, ist es von großer Bedeutung, die Wirkung von Hypoxie auf ihr Regenerations- und Differenzierungspotenzial zu untersuchen. Viele Studien haben bereits gezeigt, dass Hypoxie einen negativen Einfluss auf die osteogene Differenzierung hat. In dieser Studie wurde erstmals gezeigt, dass sowohl primäre hMSCs als auch schnell wachsende , hTERT (humane Telomerase Reverse Transkriptase) -immortalisierte hMSCs während statischer 3D-Kultur niedrigen Sauerstoffkonzentrationen ausgesetzt sind. Für Sauerstoffmessungen in der Mitte der 3D-Konstrukte wurden Nadel-Sauerstoff-Mikrosensoren von PreSens verwendet. In weiteren Tests wurde untersucht, ob ein niedriger Sauerstoffgehalt von 2 % die Proliferation der hMSCs beeinflussen und eine Vorkonditionierung in Hypoxie ihr Differenzierungspotential wiederherstellen würde.
Material & Methoden
hMSCs in Passage 2 (P2) wurden von Lonza (Verviers, Belgien) gekauft und in allen Experimenten verwendet. Zellen eines primären Spenders, und zur Wiederholung von Schlüsselexperimenten hMSCs zwei weiterer Spender, wurden verwendet. hTERT-immortalisierte hMSCs, die in unserem Labor entwickelt wurden, vermehren sich schneller als primäre hMSCs und dienten in allen Experimenten als Kontrolle. Sie stammten von einem einzelnen zellselektionierten Klon der hTERT-immortalisierten hMSCs und wurden als „single cell picked clone 1“ (SCP-1) bezeichnet. Alle Zellen wurden in minimal essentiellem Medium alpha mit L-Glutamin (Invitrogen, Carlsbad, CA) [1] bei 37 ºC in einem Standard-Zellkulturinkubator (21 % O2, 5 % CO2) expandiert. Für die statische 3D-Kultur wurden zylindrische, demineralisierte Knochenmatrix-Gerüste (Tutogen, Neunkirchen, Deutschland) mit einem Durchmesser von 9 mm und einer Höhe von 5 mm mit 1 Million P8-Zellen geimpft [2]. Die Zellgerüstkonstrukte wurden in eine 24-Well Platte (Nunc, Wiesbaden, Deutschland) überführt und 7 Tage unter Standardbedingungen kultiviert. Zur Sauerstoffmessung in den 3D-Kulturen wurden nadelförmige Sauerstoff-Mikrosensoren (PreSens, Regensburg, Deutschland) in das geometrische Zentrum der 3D-Konstrukte eingeführt, die entweder mit 1 Million hMSCs oder mit 1 Million SCP-1-Zellen besiedelt waren. Nach 4 Tagen wurde einmalig frisches Medium zugegeben. Die Wirkung von Hypoxie auf hMSCs wurde getestet, indem die Zellen in einem Multigas-Inkubator (MCO-5M, Sanyo, Pfaffenhofen, Deutschland) gehalten wurden, der ein Gasgemisch aus 93 % N2, 5 % CO2 und 2 % O2 aufrechterhielt. Für die osteogene Differenzierung wurden P6-hMSCs in einer 6-Well Platte (Nunc) mit einer Dichte von 300 Zellen/cm2 nach Trypsinisierung ausplattiert. Sie wurden unter Normoxie kultiviert, bis Subkonfluenz erreicht wurde. Dann wurden drei der sechs Wells in jeder Platte induziert, um in Richtung der Osteoblastenlinie auszudifferenzieren [3]. Die Zellen wurden in osteogenem Differenzierungsmedium [1] gezüchtet, und zur Negativ-Kontrolle die verbleibenden drei Wells mit vollständigem Medium kultiviert. Nach der Induktion wurden die Platten entweder in einer sauerstoffarmen Atmosphäre von 2 % O2 für die verbleibende Differenzierungszeit inkubiert (hypoxische Proben) oder sie wurden unter normoxischen Bedingungen (normoxische Kontrollproben) gehalten. Die hypoxische Präkonditionierung wurde durch Expansion von P6-hMSCs unter hypoxischen Bedingungen von 2 % O2 bis zum Erreichen der Subkonfluenz durchgeführt. Die osteogene Differenzierung wurde dann unter Hypoxie (2 % O2) auf die gleiche Weise wie für die hypoxischen Proben beschrieben durchgeführt. Ein Hypoxie-Nachweis-Assay und auch eine Western-Blot-Analyse von Hif-1-alpha wurden durchgeführt, um hypoxische Bedingungen nachzuweisen [1]. Hif-1-alpha ist Teil einer komplexen Signalkaskade, die induziert wird, wenn Zellen auf hypoxische Bedingungen reagieren. Ein wasserlöslicher Terazoliumsalz-Test wurde durchgeführt, um die metabolische Aktivität der Zellen während längerer Hypoxie-Exposition zu überwachen. Nach 21 Tagen osteogener Differenzierung wurde eine Alizarin-Rot-Färbung gemacht, um Kalziumablagerungen zu zeigen [1]. Zusätzlich sollte ein RT-PCR-Assay weitere zeitliche Expressionsmuster wichtiger osteogener Marker während der osteogenen Differenzierung zeigen [1].
Hypoxie und Präkonditionierung
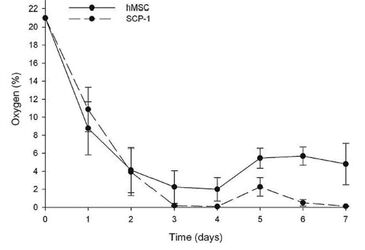
Sauerstoffmessungen in einer statischen 3D-Kultur von hMSCs und SCP-1-Zellen über 7 Tage zeigten, dass auf diese Weise kultivierte Zellen hypoxischen Bedingungen ausgesetzt sind. Die Sauerstoffkonzentration in der zentralen Region von hMSC-besiedelten Gerüsten fiel am 4. Tag von 21 % O2 auf etwa 4 % Sauerstoff. Nach dem Wechsel des Mediums stieg der Sauerstoffgehalt auf etwa 5,7 %, wo er sich stabilisierte. Die gut wachsenden SCP-1-Zellen hingegen verbrauchten Sauerstoff schneller, was am 3. Tag zu einem Absinken auf 0 % führte. Bei Zugabe von frischem Medium stieg der Sauerstoffgehalt kurzzeitig auf ca. 2 %, bevor er wieder auf 0 % abfiel (Abb. 1). In den 2D-Experimenten wurde das Hif-1-Alpha-Protein in den hypoxischen Proben, jedoch nicht in den normoxischen Kontrollproben nachgewiesen. hMSCs wurden in Gegenwart von 21 % Sauerstoff osteogen differenziert und mit Proben verglichen, die bei 2 % Sauerstoffatmosphäre kultiviert wurden. Normoxische Proben differenzierten gut, was durch eine starke Alizarin-Rot-Färbung bestätigt wurde, während die Zellen unter Hypoxie sich schlecht ausdifferenzierten. Das deutet auf eine verringerte oder verzögerte osteogenen Differenzierung unter sauerstoffarmen Bedingungen hin. Als Kontrolle wurde die osteogene Differenzierung überwacht, indem die zeitlichen RNA-Expressionsmuster der repräsentativen osteogenen Marker ALP und OPN gemessen wurden. Die RT-PCR-Ergebnisse zeigten, dass das Expressionsniveau von OPN unter Normoxie vom 5. über den 16. bis zum 21. Tag konstant anstieg. Die Expression von ALP war genau so hoch. Bei Differenzierung von Zellen unter Hypoxie war die Expression der beiden Marker an den Tagen 16 und 21 deutlich reduziert. Die Hochregulierung von ALP hingegen war am 5. Tag auch unter Hypoxie nahezu identisch, während die OPN-Expression im hypoxischen Versuch verglichen mit normoxischen Proben sogar noch höher war. Um zu testen, ob die Vorkonditionierung von hMSCs in Hypoxie ihr Differenzierungspotential unter konstanter Hypoxie verbessert, wurden die Zellen vor der osteogenen Differenzierung 3 Tage lang in 2 %iger Sauerstoffatmosphäre kultiviert. Die Ergebnisse zeigten, dass diese Behandlung die Differenzierungskapazität wiederherstellte, was durch eine positive Alizarin-Rotfärbung bestätigt wurde. Die RT-PCR-Ergebnisse zeigten, dass die hypoxische Präkonditionierung, sowohl die OPN- als auch die ALP-Hochregulierung nach osteogener Induktion an den Tagen 16 und 21 wiederherstellte. Ein Vergleich von normoxischen, vorkonditionierten und nicht vorkonditionierte hypoxische Proben zeigte zwar ein signifikant geringeres aber dennoch beträchtliches Färbeergebnis der vorkonditionierten Proben im Vergleich zu normoxischen Proben, während es tatsächlich keine nachweisbare Alizarin-Rot-Färbung in Proben aus dem hypoxischen Versuch gab. Um die Ergebnisse zu verifizieren, wurden die Schlüsselexperimente mit Zellen von zwei weiteren Spendern mit fast identischem Ergebnis wiederholt.
Zusammenfassung
Die Ergebnisse, die bei der Messung von Sauerstoff in 3D-Kultur mit hMSCs und hTERT-immortalisierten hMSCs erhalten wurden, legen nahe, dass sich primäre hMSCs besser an die sauerstoffarme Atmosphäre anpassen als die SCP-1-Zellen. Eine Erklärung könnte sein, dass primäre hMSCs einfach langsamer wachsen und somit mehr Zeit haben, die Proliferation zu verlangsamen, wenn der Sauerstoffgehalt sinkt. Diese Tatsache muss bei der Verwendung von genetisch veränderten Stammzellen für die regenerative Medizin berücksichtigt werden. Die Ergebnisse unterstützen die These, dass die Präkonditionierung von hMSCs ihr Potential zur Differenzierung in die osteoblastische Linie unter konstanten sauerstoffarmen Bedingungen verbessern kann. Wir nehmen an, dass der Prozess der osteogenen Differenzierung durch Änderungen der Sauerstoffspannung gestört wird, während konstante Bedingungen den Prozess der Differenzierung unterstützen. Dies würde erklären, warum hMSCs differenzieren, wenn sie entweder unter konstanter Normoxie oder bereits 3 Tage vor der Differenzierung schon unter hypoxischen Bedingungen kultiviert wurden. Hypoxische Präkonditionierung könnte ein hilfreiches Werkzeug für erfolgreiche zellbasierte Therapien sein.
Applikationsbericht nach
[1] Volkmer et al., 2010, Hypoxic Preconditioning of Human Mesenchymal Stem Cells Overcomes Hypoxia-Induced Inhibition of Osteogenic Differentiation, Tissue Eng. Part A vol. 16, pp. 153 - 164
Referenzen
[2] Volkmer et al., 2008, Hypoxia in Static and Dynamic 3D Culture Systems for Tissue Engineering of Bone, Tissue Eng. Part A Vol. 14, 1331
[3] Seitz et al., 2007, Influence of in vitro Cultivation on the Integration of Cell-matrix Constructs after Subcutaneous Implantation, Tissue Eng. Vol. 13, 1059