Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
In vivo Monitoring von Hämolymph-pCO2 in Libellennymphen zur Bestimmung des Ruhezustandswertes
Verwendung von faseroptischen pCO2 Mikrosensoren zur zuverlässigen in vivo Messung des Hämolymph-pCO2 von Insekten
Daniel J. Lee1, Fernando Martinez Ferreras2, Martin Gutbrod2 und Philip G. D. Matthews1
1University of British Columbia, Department of Zoology, British Columbia, Kanada
2PreSens Precision Sensing GmbH, Regensburg, Deutschland
Ziel dieser Studie war es, den Hämolymph-pCO2 wasseratmender Libellennymphen in vivo zu überwachen. Die kleine Körpergröße und das geringe Hämolymphvolumen dieser Tiere ließen jedoch die Verwendung von Standard in vitro Messtechniken und pCO2-Elektroden nicht zu. Um diese Probleme zu umgehen, verwendeten wir PreSens faseroptische pCO2 Mikrosensoren mit einem Durchmesser von 250 μm, die direkt in das Haemocoel der Insekten implantiert werden konnten, um eine kontinuierliche Echtzeitüberwachung des pCO2 in der Hämolymphe zu ermöglichen. In Kombination mit Videoüberwachung der abdominalen Ventilationsfrequenz zeigen die Testergebnisse, dass der Hämolymph-pCO2 einer ruhenden Libellennymphe zwischen 1 und 1,5 % schwankt, wobei er umgekehrt zur Ventilationsrate variiert.
In Wasser steht ungefähr 30 Mal weniger Sauerstoff (O2) zur Verfügung als in Luft [1], daher müssen wasseratmende Tiere große Mengen an Wasser ventilieren, um ausreichende Mengen an O2 zu extrahieren. Da Wasser aber auch ein guter Kohlendioxid(CO2)-Akzeptor ist, sorgt die hohe Ventilationsrate der Wasseratmer dafür, dass sie schnell ihr respiratorisches CO2 ausscheiden, was zu einem niedrigen internen pCO2 führt. Im Vergleich dazu können Luftatmer ihre O2-Anforderungen leicht erfüllen und somit langsamer atmen, was zu einer größeren Ansammlung von internem CO2 führt. Dieser Unterschied in den internen CO2-Werten zwischen Luft- und Wasseratmern wurde bei einer Vielzahl von wasseratmenden Tierlinien beobachtet, die die Fähigkeit entwickelt haben, Luft zu atmen, einschließlich Fischen [1, 2], Amphibien [3] und Krebstieren [3, 4]. Diese Beobachtung hat zu der Annahme geführt, dass ein niedriger interner pCO2 eine unvermeidbare Konsequenz des Wasseratmens ist. Da es sehr schwierig ist pCO2 in kleinen Tieren zu messen, gibt es jedoch keine Informationen darüber, wie sich die Blut- / Gaswerte von entwicklungsamphibischen Insekten ändern, wenn sie während ihres Lebenszyklus vom Wasseratmen zur Luftatmung übergehen. Die Messung des internen pCO2 in Insekten ist keine einfache Aufgabe. Aufgrund ihrer geringen Körpergröße ist es schwierig, mehr als einige Mikroliter Hämolymphe zu erhalten, was den Einsatz von Gasanalyseverfahren, die größere Blutvolumina erfordern, unmöglich macht. Das Fehlen von Kanülierungstechniken erschwert zusätzlich die Messung von physiologisch relevantem pCO2 bei Wasserinsekten, da eine Blutentnahme erst erfolgen kann, wenn das Tier aus dem Wasser entfernt wurde. Mit pCO2-Mikrosensoren lassen sich jedoch all diese Probleme umgehen, da sie klein genug sind, um für die in vivo Messung von pCO2 direkt in das Haemocoel von Wasserinsekten implantiert zu werden.
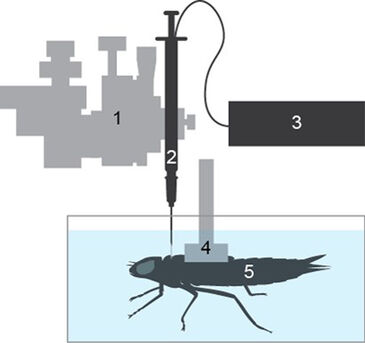
Material & Methoden
Überwachung des internen pCO2
pCO2 Mikrosensoren in Nadelbauweise wurden in 0,9 % NaCl-Lösung mit 0, 0,1, 1, 3 und 5 % CO2 in N2 kalibriert, indem ein zertifiziertes, komprimiertes 5 % CO2 in N2 Gasgemisch mit N2 gemischt wurde, unter Verwendung zweier 0 - 500 ml min-1 Massendurchflussreglern (MC-500SCCM-D / 5M, Alicat, Arizona, USA). Wasser-atmende Anax junius Libellennymphen wurden von lokalen Teichen um den Point Grey Campus der Universität von Britisch Columbia gefangen. Sie wurden einzeln, für mindestens zwei Wochen, in 2-Liter-Aquarien mit einem Rückführungsfiltersystem unter Laborbedingungen (20 - 21 °C und 12:12 Tageslichtzyklus) gehalten. Vor der Messung wurden die Nymphen im letzten Larvenstadium aus ihren Aquarien entnommen und ihre Rückenoberflächen schnell mit Papierhandtüchern abgetupft. Die dorsalen Flügelknospen der Nymphen wurden dann in ein konkaves Kunststoffgeschirr gepresst, das mit Polyvinylsiloxan-Zahnabdruckmaterial (President Light Body Impression Material, Coltène Whaledent, Schweiz) bedeckt war, das aushärtete. Nach dem Erstarren wurde das Geschirr an einem 3-Achsen-Mikromanipulator (M33301R, World Precision Instruments, USA) befestigt, der zur Positionierung der Nymphen auf dem Boden eines 10 × 11 × 17 cm großen Polypropylenbehälters (1) verwendet wurde. Der Behälter wurde in ein temperaturkontrolliertes Wasserbad getaucht und bei 21 °C gehalten. Ein zweiter Mikromanipulator, an dem eine 1-ml-Subkutanspritze mit einer 20-Gauge-Nadel befestigt war, wurde verwendet, um in der Mitte des Thorax zwischen den Pro- und Mesothorax-Segmenten ein kleines Loch in die Haut der Nymphe zu stechen. Die Spritze wurde dann durch einen kalibrierten pCO2 Mikrosensor (PreSens, Deutschland) ersetzt und ungefähr 1 mm der faseroptischen Sensorspitze wurde in das Loch eingeführt. Das Loch und der Sensor wurden dann mit Polyvinylsiloxan-Zahnabdruckmaterial bedeckt, um die Stelle wasserdicht zu verschließen. Der Polypropylenbehälter wurde dann mit entchlortem Vancouver-Leitungswasser gefüllt, kontinuierlich mit Raumluft belüftet und mit einem feinem Netz bedeckt, um visuelle Agitation der Nymphen zu reduzieren. Die pCO2-Werte wurden alle fünf Minuten mit dem pCO2 micro (PreSens, Deutschland) und der pCO2 micro View Software (PreSens, Deutschland) aufgezeichnet.
Ventilationsfrequenz
Um die Hämolymphe-pCO2-Messungen mit dem Gasaustauschverhalten der Insekten zu vergleichen, wurde die Ventilationsfrequenz überwacht, indem das abdominale Pumpen mit einer Schwarz-Weiß-Kamera (Ikegami, Japan) aufgezeichnet wurde. Die Kamera wurde an einen Desktop-PC mit EthoVision XT (EthoVision, USA) angeschlossen, der die Veränderung der Abdomenfläche aufzeichnete. Die Daten wurden mit Labchart 8 (ADInstruments, Australia) analysiert, um die durchschnittlichen Atemzüge pro Minute während einstündiger Intervalle zu ermitteln.
pCO2 Mikrosensorstabilität
Um die Stabilität des pCO2 Mikrosensors zu bestimmen, wurden sie unmittelbar nach der Kalibrierung und erneut 40 h nach Implantation in die Libellennymphe in 0,9 %-igen NaCl-Lösungen getestet, die auf 2 und 3 % gasförmiges CO2 in N2 äquilibriert waren.
Ergebnisse
Überwachung des internen pCO2
Messungen wurden an einer Nymphe durchgeführt, und die Datenkurve ist in Abbildung 2 gezeigt. Nach 20 Stunden hatte sich der pCO2 zwischen 1 und 1,5 % stabilisiert, und die Ventilationsfrequenz war auf 10 BPM (breaths per minute) gesunken. Sowohl die pCO2- als auch die Ventilationsfrequenz begannen dann in umgekehrter Weise zu oszillieren (Abb. 2, 3). Es schien jedoch einen allgemeinen Trend zu geben, bei dem sich pCO2 zwischen 1 und 1,5 % stabilisierte, wann immer die Ventilationsfrequenz innerhalb der normalen "Ruhe"-Frequenz von 5 bis 10 BPM lag, die zuvor in ruhenden Libellennymphen bestimmt wurde. Dieser Befund legt nahe, dass Libellennymphen 20 Stunden nach der Implantation einen Ruhe-pCO2-Wert von 1 - 1,5 % erreichen. Außerdem zeigt dies, dass die pCO2 Mikrosensoren in der Lage sind, Änderungen des internen CO2 als Reaktion auf Änderungen der Ventilation aufzulösen.
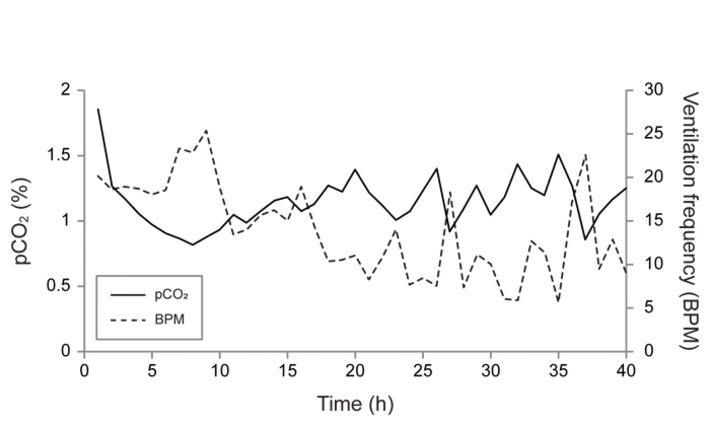
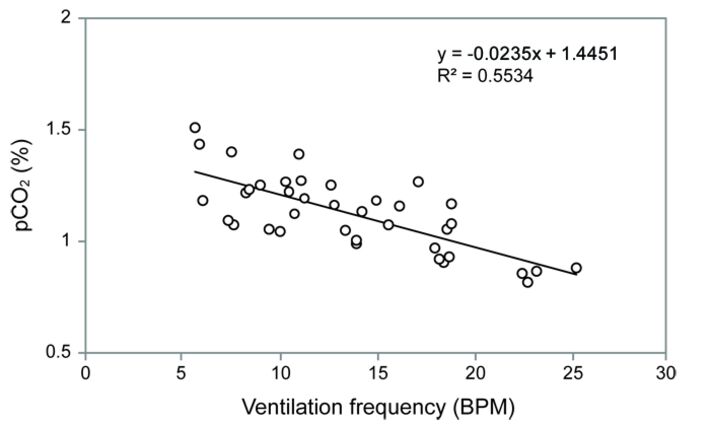
Prüfung der Langzeitstabilität
Der implantierte Mikrosensor wurde intakt wieder aus der Nymphe entfernt, wodurch sich die pCO2-Aufzeichnungen vor und nach der Implantationsperiode vergleichen ließen (Abb. 4). Wie erwartet, waren die pCO2-Werte nach der Implantation etwas höher. Dies war auf das langsame Photobleichen des Mikrosensors während 866 Aufzeichnungsereignissen zurückzuführen. Die Sonden waren jedoch robust genug, um intakt wieder aus der Nymphe entfernt zu werden, und die kleine Drift zu quantifizieren. In der physiologischen Umgebung der Insekten-Hämolymphe blieben die Sonden stabil. Dies zeigt, dass der Mikrosensor während des Experiments genaue pCO2-Messungen lieferte.
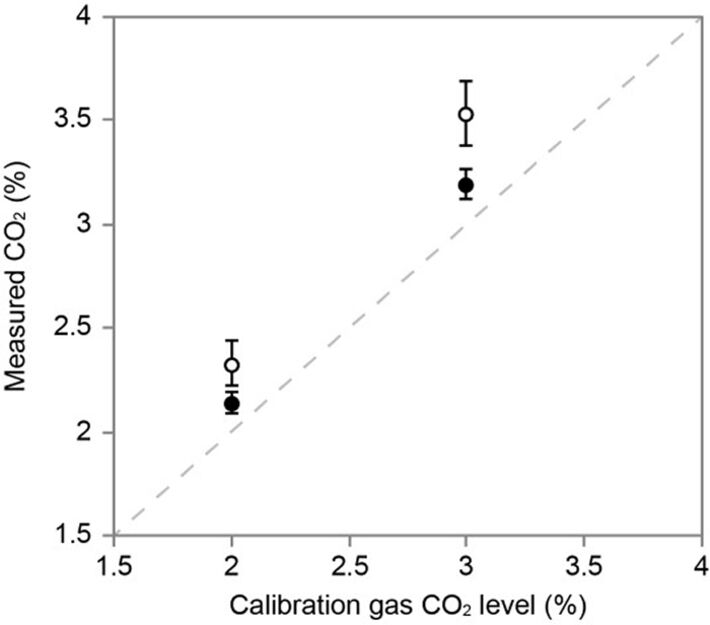
Zusammenfassung
PreSens pCO2 Mikrosensoren ermöglichten die in vivo Überwachung des Hämolymphe-pCO2 in einem kleinen aquatischen Invertebraten, eine Aufgabe, die mit anderen konventionellen Methoden nicht möglich ist. Somit wären diese Mikrosensoren ideale Kandidaten für die Überwachung von CO2-Niveaus in anderen kleinen biologischen Systemen.
Referenzen
[1] Ultsch, G. R. (1996). Palaeogeogr. Palaeocl. 123: 1 - 27
[2] Garey, W. G. and Rahn, H. (1970). Resp. Physiol. 9: 141 - 150
[3] Erasmus, B. W., Howell, B. J. and Rahn, H. (1970). Resp. Physiol. 11: 46 - 53
[4] Truchot, J. P. (1975). Resp. Physiol. 23: 351 - 360


