Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Ischämie-bedingte Zellschädigung in extrakorporal konserviertem Gewebe
Neue Erkenntnisse mit einem neuartigen Perfusionsmodell unter Verwendung optischer pO2, pCO2 und pH Sensoren
C. D. Taeger1, W. Müller-Seubert1, R. E. Horch1, K. Präbst2, F. Münch3, C. I. Geppert4, T. Birkholz5, A. Dragu1
Lehrstuhl für Plastische und Handchirurgie1, Bioverfahrenstechnik2, Herzchirurgie3, Pathologie4, Anesthesiologie5, Friedrich-Alexander-Universität Erlangen-Nürnberg, Deutschland
Gewebe, das bei Transplantation oder rekonstruktiver Chirurgie frei transferiert wird, ist immer dem Risiko Ischämie-bedingter Zellschädigungen ausgesetzt. Diese Studie zielte darauf ab, verschiedene Verfahren unter Verwendung eines extrakorporalen Perfusions- und Oxygenierungssystems zu bewerten. In diesem System wurden Durchflusszellen mit integrierten O2-, pH- und CO2-Sensoren implementier, um das Perfusat bevor und nach dem es einen freien Muskellappen passiert hatte online zu überwachen. Darüber hinaus untersuchten wir die Expression von HIF-1 alpha als Hypoxie-Marker und des pro-apoptotischen Proteins Caspase-3 in den Skelettmuskellappen, um Verbesserungen der Gewebekonservierung durch die verschiedenen Verfahren zu bewerten. Die Ergebnisse zeigen, dass eine luftgesättigte Lösung dem freien Muskellappen ausreichend Sauerstoff zuführt, und eine erhöhte Expression von HIF-1 alpha und Caspase-3 durch in dieser Studie angewandte Verfahren verhindert werden kann.
Während des letzten Jahrzehnts wurden zahlreiche Fortschritte auf dem Gebiet der Transplantationsmedizin erzielt. In diesem Zusammenhang hat nicht nur der Organerhalt, sondern auch die extrakorporale Gewebekonservierung enorme Fortschritte gemacht. In der rekonstruktiven Chirurgie stellt der freie Transfer von Skelettmuskeln ein standardisiertes mikrochirurgisches Werkzeug dar, z. B. bei der Rekonstruktion geschädigter Extremitäten. In 5 % aller Fälle können jedoch Komplikationen und sogar vollständiges Versagen aufgrund partieller oder vollständiger Nekrose des transplantierten Gewebes auftreten. Gewebeschäden, verursacht durch anhaltende Ischämie nach der Entnahme des Lappens, sind immer noch einer der limitierenden Faktoren. Ischämie beschreibt einen Zustand eingeschränkter oder vollständig inhibierter Blutversorgung, der zu Sauerstoff- und Nährstoffmangel führt. Niedrige Sauerstoffkonzentrationen verursachen nicht nur während der Dauer der Ischämie, sondern auch nach der Wiederherstellung der Zirkulation Schäden im Gewebe. Die Wiederzufuhr von Sauerstoff sowie anderer Komponenten verursacht die Freisetzung freier Radikale, die bereits entstandene Schäden noch verschlimmern. In der Vergangenheit wurden verschiedene Ansätze zur Optimierung der Sauerstoffversorgung des Gewebes während der Ischämie durchgeführt. Momentan besteht das Standardverfahren für die Konservierung von Gewebelappen in der rekonstruktiven Chirurgie meistens darin, sie nach der Entnahme mit einer einzigen Spülung von Salzlösung zu behandeln, gefolgt von einer Kühllagerung bis sie mit dem Blutkreislauf wieder verbunden werden. Diese Studie wurde durchgeführt, um mehr über den Einfluss verschiedener Parameter zu erfahren, die die Ischämie-bedingte Zellschädigung des stark Ischämie-anfälligen Skelettmuskels beeinflussen, und Schlussfolgerungen für mögliche Anwendungen in der klinischen Routine ziehen könnten.
Material & Methoden
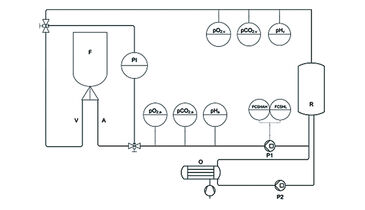
In dieser Studie wurden n = 24 Muskellappen verwendet. Nach der Entnahme wurden die vier Gewebelappen der Gruppe I ohne weitere Behandlung bei Raumtemperatur gelagert (Kontrollgruppe). In Gruppe II wurden Kanülen in die Arterie und Vene von fünf Lappen eingeführt und an das Perfusions- und Oxygenierungssystem angeschlossen (Abb. 1, schematisches Modell). Die Lappen der Gruppe II wurden unmittelbar nach der Entnahme für 60 min mit einer Kardioplegie-Lösung (Histidin-Tryptophanketoglutarat-Lösung) perfundiert. In Gruppe III erhielten fünf Muskeln eine arterielle Nadel, wurden unmittelbar nach der Entnahme mit einer einzigen Spülung von 10 ml Kardioplegie-Lösung behandelt und wurden dann weiter unbehandelt belassen. In Gruppe IV wurden Kanülen sowohl in der Arterie als auch in der Vene von fünf Gewebelappen eingeführt, um eine Verbindung zu unserem Perfusions- und Oxygenierungssystem zu ermöglichen. Die Lappen in Gruppe IV wurden mit einer heparinisierten kristalloiden Flüssigkeit - mit einer Osmolarität von 291 mOsm / Liter (Jonosteril®) - perfundiert und oxygeniert. In Gruppe V wurden fünf Lappen perfundiert und ähnlich der Gruppe IV mit heparinisierter Kardioplegie-Lösung oxygeniert. Die konstante Perfusion wurde mit einer Flussraten-regulierenden Pumpe (Abb. 1, P1; Infusomat ® Space P, Braun Melsungen, Deutschland) und einem Fluss von 10 ml / min durchgeführt. Arterielle und venöse Drücke wurden kontinuierlich überwacht. Die Oxygenierung mit Umgebungsluft erfolgte durch einen Neonatal-Oxygenator (Abb. 1, O; SAFE Micro®, Polystan, Dänemark) in einem Sekundärkreislauf. Der Primärkreislauf entnahm dem Sekundärkreislauf, der über eine eigene Pumpe verfügte, frisch oxygeniertes Perfusat (Abb. 1, P2). Während der aktiven Perfusion wurden pO2, pCO2 und pH des Perfusats kontinuierlich auf der arteriellen (Abb. 1, pO2a, pCO2 a, pH a) und venösen Seite des Perfusionssystems (Abb. 1, pO2 v, pCO2 v, pH v) überwacht. Alle Parameter wurden mit optischen Sensoren, die in Durchflusszellen integriert sind und nicht-invasive Datenerfassung mit schneller Ansprechzeit ermöglichen, gemessen. Zum Auslesen der Sensoren waren die Durchflusszellen über Polymer-Lichtwellenleiter mit dem jeweiligen faseroptischen Messgerät verbunden (OXY-4 mini, pCO2 mini, pH-1 mini, PreSens, Deutschland). Die Datenerfassung wurde mit einer Rate von 4 min-1 durchgeführt. Die Verwendung von Durchflusszellen mit integrierten Sensoren ermöglicht die Parameterbestimmung ohne die Durchflussrate und Salzkonzentration in den Perfusaten zu beeinflussen. Um die Auswirkungen der verschiedenen Verfahren auf die Expression von Caspase-3 und HIF-1 alpha zu bestimmen, wurde 0 (Baseline), 15, 30 und 60 min nach der Explantation eine Biopsie durchgeführt. Biopsien wurden in Formalin bei Umgebungstemperatur gelagert, bevor sie in Paraffin eingebettet wurden. Aus dem vorbereiteten Probenblock wurde ein Objektträger pro Färbemethode entnommen.
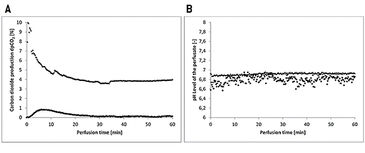
Ergebnisse
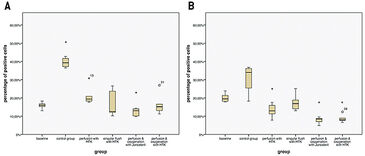
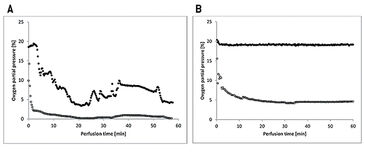
Die Gewebelappen der Gruppen ohne Oxygenierung extrahierten den Sauerstoff während der Perfusion nahezu vollständig, da der venöse pO2 auf etwa 0 % sank (Abb. 2A). Im Gegensatz dazu stabilisierte die Zufuhr von 21 % O2 (Umgebungsluft) über einen Oxygenator den arteriellen pO2 und der pO2 im venösen Zweig blieb bei 5 % (Abb. 2B). Die Sauerstoffaufnahme des Gewebes führte auch zu unterschiedlichen CO2-Ausscheidungen in das Perfusat (Abb. 3A). Während die maximale Differenz von venösem zu arteriellem pCO2 im Perfusat von Geweben ohne zusätzlicher Sauerstoffversorgung nicht über 1 % hinausreichte, wurde mit Oxygenierung ein pCO2-Unterschied von anfänglich 10 % gemessen, der selbst nach einer Stunde Perfusion noch einen mittleren Wert von 3,9 % aufwies. Arterielle und venöse pH-Werte des Perfusats zeigten keine inkonsistenten Werte. Daher wurde ein mittlerer pH-Wert des Perfusats verwendet, um Perfusate in Gewebe mit und ohne zusätzlicher Sauerstoffversorgung zu vergleichen (Abb. 3B). Beide Kurven zeigen eine leichte Erhöhung des pH-Wertes über die Perfusionszeit von einer Stunde. Die histologische Analyse zeigte, dass alle Verfahren (Gruppen II - V) im Vergleich zur Kontrollgruppe (Gruppe I) nach 60 min signifikant niedrigere Expressionsraten von Caspase-3 aufwiesen, wobei Gruppe IV (Perfusion und Oxygenierung mit einer kristalloiden Lösung) beste Ergebnisse erzielte (Abb. 4A). Ein signifikant niedrigeres Niveau von HIF-1 alpha im Vergleich zu der Kontrollgruppe (Gruppe I) konnte nach 60 min nur in Gruppen nachgewiesen werden, in denen die Lappen kontinuierlich entweder mit kristalloider oder Kardioplegie-Lösung perfundiert worden waren (Gruppen II, IV, V). Ein Vergleich der Kontrollgruppe (Gruppe I) mit den behandelten Gruppen (Gruppen II-V) bestätigt, dass alle Behandlungen (außer einmalige Spülung mit Kardioplegie-Lösung, Gruppe III) die HIF-1 alpha-Expression verringerten (Abb. 4B).
Zusammenfassung
Unsere Daten legen nahe, dass es Methoden gibt, um erhöhte Expression von HIF-1 alpha und Caspase-3 während der Konservierung von Gewebelappen zu verhindern. Nicht-invasive Messungen mit den in unserem Perfusions- und Oxygenierungssystem integrierten Durchflusszellen und gleichzeitige Überwachung von O2, pH und CO2 lieferten wertvolle Informationen über den Sauerstoffbedarf und die CO2-Exkretion des untersuchten Muskelgewebes sowie den pH-Wert des Perfusats. Zusammenfassend konnte eine Optimierung der Organ- und Gewebekonservierung mit einfachsten Mitteln durch eine nicht rezirkulierende Infusion realisiert werden. Eine luftgesättigte Lösung ist in der Lage, den Sauerstoffbedarf eines freien Gewebelappens zu decken, und solange keine Rezirkulation stattfindet, ist eine zusätzliche Sauerstoffzufuhr entbehrlich. Solche Methoden könnten in der klinischen Routine implementiert werden.
Applikationsbericht nach
C. D. Taeger et al. (2014): Ischemia-related cell damage in extracorporeal preserved tissue - new findings with a novel perfusion model, J. Cell. Mol. Med. 18: 885 - 894.
DOI: 10.1111/jcmm.12238