Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Lokalisierte Sauerstoffverminderung durch Transmigration von Neutrophilen beeinflusst Entzündungsrückgang
Sauerstoffüberwachung in Zell-Zell-Cross Talk Experimenten mit dem SDR SensorDish® Reader
Eric L. Campbell, und Sean Colgan
Mucosal Inflammation Program, University of Colorado, Anschutz Medical Campus, USA
Jüngste Forschungsergebnisse zu Darmentzündungen haben gezeigt, dass der mukosale Metabolismus den Krankheitsverlauf beeinflusst. Die intestinale Entzündung wird begleitet von einer Akkumulation von Neutrophilen (polymorphonukleare Leukozyten = PMNs). Hier untersuchten wir den Einfluss von transmigrierenden PMNs auf den O2-Metabolismus der umgebenden Mukosa. Die Sauerstoffüberwachung in Zell-Zell-Cross Talk Versuchen wurde in OxoDishes® mit dem SDR SensorDish® Reader durchgeführt. Unsere Ergebnisse zeigten, dass PMNs den lokalen molekularen Sauerstoff derart schnell aufbrauchen, dass Epithelzellen in unmittelbarer Nähe die HIF (Hypoxie-induzierbarer Faktor) -Transkriptionsmaschinerie stabilisieren. Darüber hinaus demonstrierten wir, dass eine solcher lokaler O2-Rückgang für die Auflösung entzündlicher Prozesse entscheidend ist.
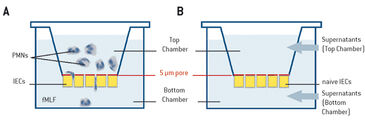
Die Transmigration von Neutrophilen zu infektiösen oder verletzten Stellen ist für die körpereigene Abwehr notwendig. Eine Akkumulation von PMNs während einer Darmentzündung kann jedoch zu chronischen Entzündungszuständen führen. Die Infiltration des infizierten Gewebes durch PMNs wird von energiefordernden Prozessen, wie etwa Migration, Phagozytose und Erzeugung eines NADPH-Oxidase-Bursts, begleitet, von denen angenommen wird, dass sie im Gewebe während einer Entzündung metabolische Veränderungen verursachen. In diesem Zusammenhang könnten PMNs einen entscheidenden Einfluss auf die umgebenden Zellen haben, aber es ist immer noch sehr wenig darüber bekannt, wie solche Veränderungen die Gewebefunktion und den Krankheitsverlauf beeinflussen. In diesen Experimenten analysierten wir, wie PMNs die Mikroumgebung des Gewebes durch das Aufbrauchen des lokalen molekularen Sauerstoffs beeinflussen und ob dies einen Effekt auf das Transkriptionsprofil der Zellen hat. Wir entwickelten eine Versuchsanordnung, um den Zell-Zell-Cross Talk in einem direkten und indirekten Modell zu analysieren (Abb. 1). Zur Überwachung des Sauerstoffverbrauchs von aktivierten PMNs verwendeten wir den SDR SensorDish® Reader von PreSens und 24-Well OxoDishes®, mit integrierten Sauerstoffsensoren. Online-Messungen mit dem SDR waren für unsere Experimente sehr vorteilhaft, da sie eine Hochdurchsatzanalyse ermöglichten. Mit Hilfe dieses Modells konnten wir zeigen, wie aktivierte PMN den lokalen molekularen Sauerstoff schnell abbauten und wie dies die umgebenden Epithelzellen beeinflusste. In vivo Tests (hier nicht beschrieben, siehe [1]) zeigten darüber hinaus, wie eine solche lokalisierte O2-Verminderung zu einem wirksamen Schutz der Schleimhäute und zur Entzündungshemmung beiträgt.
Material & Methoden
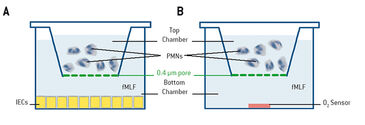
Neutrophile wurden während der direkten Transmigration, indirekten Transmigration, Kokultur oder in Echtzeit-Sauerstoffmonitoring Experimenten mit dem SDR-System untersucht. Für die direkte Transmigration wurden T84-Intestinalepithelzellen (IEC) auf der Unterseite von kollagenbeschichteten durchlässigen Transwell-Trägern (5,0 μm Poren; Corning) gezüchtet. Neutrophile (1 × 106) wurden in der oberen Kammer aufgetragen. In der unteren Kammer wurde ein chemotaktisches Mittel (1 μm fMLF = N-Formyl-Methionin-Leucin-Phenylalanin in HBSS = Hanks' Balanced Salt Solution) zugegeben und die Neutrophile durften überwandern (Abb. 1 A). Im indirekten Modell wurden konditionierte Überstände der direkten Transmigration, wie zuvor beschrieben, gesammelt. Die Überstände wurden durch Zentrifugation geklärt (350 × g für 10 min) und dann auf unbehandelte T84-Monolayer aufgebracht (Abb. 1B). Im Co-Kulturmodell wurden Epithelzellen in 24-Well Platten kultiviert (Abb. 2A), wobei PMNs über den T84-Zellen auf durchlässigen Trägern (0,4 μm Poren; Corning) suspendiert waren, was eine physische Wechselwirkung zwischen PMNs und IEC verhinderte. Die Sauerstoffüberwachung in Echtzeit wurde mit 24-Well OxoDishes® auf dem SDR SensorDish® Reader (PreSens) unter normoxischen Bedingungen durchgeführt. OxoDishes® wurden mit HBSS+ oder HBSS+, das entweder fMLF oder PMA (Phorbolmyristatacetat = ein Tumorpromotor) enthielt, voräquilibriert. Für PMN von Patienten wurde fMLF und für Maus-PMNs wurde PMA als chemotaktisches Mittel verwendet. Der Transwell-Filter trennte die PMNs vom Sensor (Abb. 2 B). Das ganze System wurde bewegt, um die ungerührte Flüssigkeit unter dem Transwell-Filter zu durchmischen. Frisch isolierte Neutrophile entweder aus vollständigem venösem Blut gesunder Freiwilliger, oder aus Knochenmark von Mäusen gewonnene PMNs wurden auf den Filter aufgebracht. PMNs von Wildtyp (C57BL/6) -Mäusen und CGD (Nox2-/-) -Mäusen (Jackson Laboratories) wurden mit dem SDR untersucht. CGD-Mäuse zeigen phänotypisch Symptome einer septischen Granulomatose (CGD), da ihren PMNs funktionelle NADPH-Oxidase fehlt, was die oxidativen Bursts der PMNs schwächt. Microarray und Analysen wurden wie in [1] beschrieben durchgeführt.
Einfluss von PMNs auf die Mikroumgebung
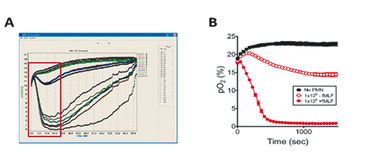
Unsere ersten Experimente konzentrierten sich auf den Einfluss der PMN-Transmigration auf das Transkriptionsprofil von Darmepithelzellen. Daher führten wir parallele Experimente eines direkten und indirekten Transmigrationsmodells für 90 min durch, extrahierten nach 2 h RNA und analysierten Transkriptionsprofile mittels Microarray. Profiling im direkten Modell ergab hauptsächlich PMN-spezifische Gene, die durch Kontamination der Monoschicht mit unvollständig migrierten Neutrophilen verursacht wurden. Die Analyse des indirekten Modells zeigte, dass Gene, die als Folge der während der Transmigration freigesetzten Faktoren reguliert wurden, vorhanden waren. Eine Reihe von Hypoxie-regulierten Genen, die in beiden Modellen als Reaktion auf PMNs induziert wurden, konnten ebenfalls identifiziert werden. Aufgrund dieser Ergebnisse wollten wir den Sauerstoffverbrauch aktivierter PMNs messen und den Einfluss des PMN-Sauerstoffverbrauchs auf das Transkriptionsprofil von IECs bestimmen. Wir verwendeten OxoDishes® mit 24 Vertiefungen, in denen PMNs über dem Sauerstoffsensor auf Filtern aufgebracht waren. Die Messungen zeigten deutlich, dass PMNs den gesamten verfügbaren O2 innerhalb von Minuten verbrauchten, abhängig von der Zellzahl und dem Aktivierungsfaktor. Um sicherzustellen, dass diese O2-Aufzehrung für Epithelzellen in unmittelbarer Nähe ausreichend war, um Hypoxie wahrzunehmen, führten wir eine Co-Kultur von PMNs, die auf einem 0,4 µm-Poren Transwellfilter über T84-Darmepithelzellen suspendiert waren, durch. Wir gaben einen Hypoxie-abhängigen Addukt-bildenden Farbstoff (Pimonidazol-HCl) hinzu und aktiviert mit fMLF. Nach 0 min und 60 min wurden die Zellen fixiert und und auf Hypoxie-Addukte mit Hypoxyprobe-1-Antikörper (Hypoxyprobe) lokalisiert. Kernextrakte zeigten, dass die PMN-Aktivierung die Stabilisierung von HIF nach 3 und 6 Stunden Exposition induzierte. Für weitere Untersuchungen zu Mechanismen des PMN-Sauerstoffverbrauchs und dem Beitrag des PMN-Atmungsbursts an dem O2-Rückgang wurden Knochenmark-PMNs sowohl von Wildtyp-C57BL/6- als auch CGD-Mäusen entnommen und die Neutrophilen mit oder ohne DPI (Diphenyleniodonium = NADPH-Oxidase Inhibitor) für 15 min auf Eis inkubiert. Daraufhin überwachten wir den O2-Verbrauch der PMNs mit dem SDR System. Aktivierte PMNs von Wildtyp-Mäusen ohne DPI verbrauchten den gesamten verfügbaren Sauerstoff schnell, während in Gegenwart von DPI der Sauerstoffverbrauch durch Wildtyp-Zellen abgeschwächt wurde. PMNs von CGD-Mäusen verbrauchten kaum Sauerstoff, weder wenn sie mit PMA aktiviert waren noch ohne Aktivierung und sowohl in An- oder Abwesenheit von DPI. Zusammenfassend zeigen alle Daten, die wir während der in vitro Tests gesammelt haben, dass die PMNs über den NADPH-Oxidase-Burst genug O2 abbauen, dass nahe gelegene Epithelzellen in der Lage sind, Hypoxie wahrzunehmen, und transkriptionell geprägt werden.
Zusammenfassung
Der experimentelle Aufbau, den wir verwendeten, erwies sich als am besten geeignet, um Zell-Zell-Cross Talk zu untersuchen, und könnte auch auf andere Zelltyp-Modelle angewendet werden. Echtzeitmessungen mit dem SDR SensorDish® Reader ermöglichten eine Hochdurchsatzanalyse mit kontinuierlichen Sauerstoffmessungen und gaben einen hervorragenden Einblick in die PMN-Sauerstoffverbrauchsraten. Diese Resultate trugen wesentlich zu unseren Erkenntnissen bei, dass die epitheliale HIF-Stabilisierung als Reaktion auf die schnelle O2-Aufzehrung durch PMNs für die Transkriptionsinduktion zahlreicher Schutzgene entscheidend ist. Weitere in vivo Tests an Mäusen zeigten, dass eine lokale O2-Aufzehrung durch PMN für die Entzündungsauflösung entscheidend ist [1]. Unsere Ergebnisse liefern wichtige Einblicke in therapeutische Möglichkeiten für entzündliche Schleimhauterkrankungen.
Applikationsbericht nach
[1] E. L. Campbell, et al.: Transmigrating Neutrophils Shape the Mucosal Microenvironment through Localized Oxygen Depletion to Influence Resolution of Inflammation; Immunity 40, pp. 66 - 77, 2014


