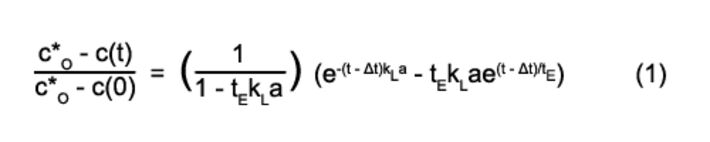Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Neuer Bioreaktor im ml-Maßstab zur Kultivierung Myzel-bildender Mikroorganismen
Bestimmung des voluminetrischen Sauerstofftransferkoeffizienten (kLa)
Ralf Hortsch1, Ansgar Stratmann2, Dirk Weuster-Botz1
1Lehrstuhl für Bioverfahrenstechnik, TU München, Deutschland
2W42 Industrial Biotechnology GmbH, Marl, Deutschland
Ein neuer gerührter Bioreaktor im ml-Maßstab wurde für die Kultivierung von Myzel-bildenden Mikroorganismen entwickelt. Durch die Implementierung eines neu entworfenen einseitigen Rührers, konnte ein verbessertes Oberflächen-Volumen-Verhältnis der flüssigen Phase erzeugt werden, mit dem Sauerstoff durch Oberflächenbelüftung in das Medium eingeführt wurde. Die sich schnell bewegende flüssige Lamelle verhinderte wirksam das Bewachsen der Wände und Schäumen in der Myzel-bildenden Kultur. In den neuen Bioreaktoren wurden unter Verwendung chemisch-optischer Sauerstoff-Mikrosensoren mit kurzer Reaktionszeit volumetrische Sauerstofftransferkoeffizienten (kLa) > 0,15 s-1 gemessen.
Die Anzahl biotechnologischer Reaktionen hat in den letzten Jahren deutlich zugenommen. Daher ist die Miniaturisierung von Bioreaktoren für die Bioprozessentwicklung besonders interessant. Eine wichtige Gruppe industrieller Produktionsorganismen sind Myzel- und Pellet-bildende Mikroorganismen wie Actinomyzeten oder Pilze, da sie beispielsweise die Mehrzahl der Antibiotika produzieren können. Ein Bioreaktorsystem zur Kultivierung von Myzel-bildenden Mikroorganismen müsste folgende Anforderungen erfüllen: Einen ausreichenden Gas-Flüssig-Stoffaustausch in viskosen Medien gewährleisten, Energie gleichmäßig in das Reaktionsmedium verteilen und ein Bewachsen der Reaktorwände effizient verhindern. Daher wurde ein neues Rührerkonzept entwickelt (Hortsch und Weuster-Botz, 2009; deutsche Patentanmeldung DE 10 2009 056 468.3). Verschiedene Tests und Messungen - wie volumetrischer Energieverbrauch, maximale lokale Energiedissipation und Referenzkultivierung im Litermaßstab - wurden durchgeführt, um die Verwendbarkeit des neuen Bioreaktorsystems zu untersuchen. Da eine ausreichende Sauerstoffversorgung für die meisten mikrobiellen Kultivierungen Voraussetzung ist, wurde der Sauerstofftransferkoeffizient kLa des neuen Rührers mit Sauerstoff-Mikrosensoren von PreSens GmbH, Deutschland, gemessen. Integrierte chemisch-optische Sensoren (PreSens) am Boden jedes Bioreaktors ermöglichten zusätzlich die Überwachung des gelösten Sauerstoffgehalts und des pH-Wertes im Kultivierungsmedium.
Material & Methoden
Der genetisch veränderte Stamm Streptomyces tendae W42-0 (W42 Industrial Biotechnology GmbH, Deutschland) diente in allen Experimenten als Modellorganismus, da dieser Aktinomyzet ausgeprägtes Verhalten filamentöser Mikroorganismen zeigt. Die neu konzipierten Einweg-Reaktionsgefäße ohne Schikanen hatten einen Innendurchmesser von ca. 20 mm. Sie waren mit dem Rührer-Prototyp ausgestattet; chemisch-optische Sensorspots für den pH-Wert und die Messung der gelösten Sauerstoffkonzentration (DO) wurden am Boden jedes Reaktors angebracht. Die Gefäße waren so konstruiert, dass sie in einen von Weuster-Botz et. al. im Jahr 2005 [4] beschriebenen Bioreaktionsblock mit maximal 48 gerührten Reaktoren passten. Ein Gasverteiler mit 48 auf indiviuellen Achsen montierten Rührern gewährleistete die sterile Gasverteilung in allen 48 gerührten Reaktoren und diente gleichzeitig als Sterilbarriere. Ein optosensorisches Messsystem - ein Sauerstoff-Mikrosensor mit einer Reaktionszeit zwischen 2 und 3 Sekunden und das faseroptische Sauerstoff-Meter Microx TX3 (PreSens) - wurde verwendet, um den Sauerstofftransferkoeffizienten in den Milliliter-Bioreaktoren zu bestimmen. Der kLa wurde unter Verwendung der dynamischen Sulfitmethode gemessen. Alle Messungen wurden in 0,5 M Na2SO4 durchgeführt. Zu Beginn jeder Messung wurde die wässrige Lösung, die 10-3 M CoSO4 als Katalysator enthielt, mit Luft gesättigt. Eine bestimmte Menge einer Na2SO3-Lösung wurde zugegeben, um den gesamten gelösten Sauerstoff zu verbrauchen, bis der Wert auf Null fiel. Nachdem das Sulfit verbraucht war, wurde die Sättigungsphase überwacht und die Gleichung 1 mit dem Levenberg-Marquardt-Algorithmus (Labview 7.4, National Instruments, Austin, Texas) an die Sättigungskurven angepasst, um den kLa-Wert zu bestimmen:
Die Sauerstoffsättigungskonzentration c*O bezieht sich auf das Einlassgas. Die Ansprechzeit tE des Sauerstoffsensors ist die Zeit, die benötigt wird, um 90 % einer Stufenänderung der gelösten Sauerstoffkonzentration zu überwachen. Die experimentelle Zeit t wird als Fließparameter eingefügt, indem eine Zeitverzögerung delta t zwischen der Zugabe von Sulfit und seinem stöchiometrischen Verbrauch ermöglicht wird [2].
kLa und DO Messungen
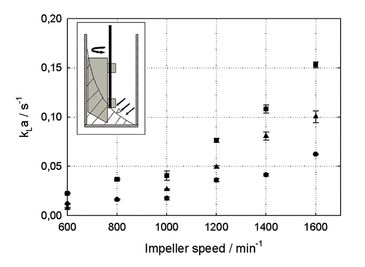
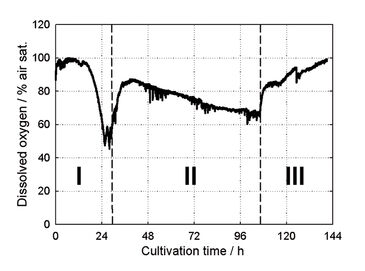
Je nach Reaktorvolumen konnten kLa-Werte von > 0,15 s-1 gemessen werden (Abb. 1). Dieser kLa ist deutlich höher als bei anderen oberflächenbelüfteten Systemen, wie z. B. Schüttelkolben, und liegt im Bereich von technischen Rührkesselreaktoren unter normalen Bedingungen mit kLa 0,05 - 0,3 s-1 [3]. Der kLa-Wert fällt aufgrund der kleineren spezifischen Gas/Flüssigkeits-Austauschfläche mit wachsendem Reaktionsvolumen ab. Mit dem neuen Rührer-Paddel konnte ein geschätztes Verhältnis von Oberfläche zu Volumen von 0.4 mm2 mm-3 für 8 ml Reaktionsvolumen und 1.600 min-1 Rührergeschwindigkeit erreicht werden; das ist etwa 10-fach höher als bei anderen Systemen ohne Paddel. Da die spezifische Gas/Flüssigkeits-Austauschfläche in oberflächenbelüfteten Prozessen nur geringfügig durch die Erhöhung der Viskosität beeinflusst wird, hat der neue Rührer viele Vorteile für Kulturen mit viskosen Medien, wie die meisten Myzel-Kultivierungen. kLa bleibt in viskosen Flüssigkeiten relativ konstant, während er in blasenbelüfteten Systemen bei der Kultivierung filamentöser Mikroorganismen bis zu 20 mal absinken kann [1]. Während der Kultivierung wurde die Konzentration des gelösten Sauerstoffs im Medium mit den integrierten chemisch-optischen Sensoren überwacht. Diese Daten zeigen, dass während der Bioreaktortests zu keinem Zeitpunkt eine Sauerstofflimitierung auftrat (Abb. 2). Das neu entwickelte Rührer-System garantiert eine ausreichende Sauerstoffversorgung der Kultur. In Abbildung 2 sind die verschiedenen Wachstumsphasen einer beispielhaft gewählten Kultivierung von Streptomyces tendae in den neu entworfenen Milliliter-Bioreaktoren zu sehen.
Zusammenfassung
Die kLa-Bestimmung und das online DO-Monitoring zeigten zusammen mit einer Reihe anderer Tests die Verwendbarkeit der neuen Milliliter-Bioreaktoren, die in einem Bioreaktionsblock zur Kultivierung von Myzel-bildenden Mikroorganismen und paralleler Bioprozessentwicklung betrieben wurden. Der gemessene kLa liegt im Bereich technischer Rührkesselbioreaktoren und ist höher als bei anderen oberflächenbelüfteten Systemen. Selbst mit steigender Viskosität kann der neue Rührer genügend Sauerstoff für die Kultur liefern. Die sich schnell bewegende Flüssigkeitslamelle verhindert wirksam ein Bewachsen der Wände und Schäumen in der Myzel-bildenden Kultur. Bei längerer Fedbatch-Kultur muss berücksichtigt werden, dass die Sauerstofftransferrate mit zunehmendem Volumen in Milliliter-Bioreaktoren abnimmt. Daher müsste möglicherweise die Rührergeschwindigkeit erhöht oder der Kopfraum der Reaktoren mit Sauerstoff angereichert werden. Online gemessene Zustandsgrößen wie DO und pH können in jedem einzelnen Reaktor mit integrierten chemisch-optischen Sensoren überwacht und geregelt werden. Das ermöglicht parallele Kultivierungen im Milliliter-Maßstab vergleichbar mit Labor- und Pilotmaßstäben.
Applikationsbericht nach
Hortsch et. al., 2010, New Milliliter-Scale Stirred Tank Bioreactors for the Cultivation of Mycelium Forming Microorganisms; Biotech. & Bioeng. Vol. 106, No. 3, pp. 443 - 451
Referenzen
[1] Badino A.C., Facciotti M.C.R., Schmidell W. (2007); Volumetric oxygen transfer coefficients (kLa) in batch cultivations involving non-Newtonian broths. Biochem Eng J 8: 111 - 119.
[2] Linek V., Vacek V., Benes P. (1987); A critical review and experimental verifiction of the correct use of the dynamic method for the determination of oxygen-transfer in aerated agitated vessels to water, electrolyte- solutions and viscous liquids. Chem Eng J 34: 11 - 355.
[3] Van´t Riet K. (1979): Review of measuring methods and results in nonviscous gas-liquid mass transfer in stirred vessels. Ind Eng Chem Process Des Dev 18: 357 - 364.
[4] Weuster-Botz D., Puskeiler R., Kusterer A., Kaufmann K., John G.T., Arnold M. (2005); Methods and milliliter scale devices for high-throughput bioprocess design. Bioprocess Biosys Eng 28: 109-119