Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Neues Gerät zur Biomasse-Überwachung in Schüttelkolbenkultur
Entwicklung einer Analyseeinheit basierend auf dem SFR Shake Flask Reader
J. Schmidt-Hager1, C. Ude1, M. Findeis2, G. T. John2, T. Scheper1, und S. Beutel1
1Institut für Technische Chemie, Leibniz Universität Hannover, Deutschland
2PreSens Precision Sensing GmbH, Regensburg, Deutschland
Wir haben ein neuartiges System zur Online-Biomasse-Messung in Schüttelkolben entwickelt, das auf einer nahezu 360 ° Streulichtdetektion basiert. Die optosensorischen Komponenten wurden mit der bewährten PreSens SFR Shake Flask Reader-Technologie kombiniert, so dass Biomasse, pO2 und pH-Wert nicht-invasiv durch den Kolbenboden überwacht werden können. Die erste Anwendung des Prototyps SFR vario auf Escherichia coli K12 und Kluyveromyces marxianus führte zu hochreproduzierbaren Online-Biomassedaten mit relativen Fehlern, die denen der Offline-OD-Standardmessungen entsprachen.
In der biopharmazeutischen Produktion sollten relevante Kultivierungsparameter während des gesamten Kulturzeitraums überwacht werden. In frühen Stadien der Bioprozessentwicklung werden häufig Schüttelkolben verwendet, da mit möglichst geringem Aufwand viele Experimente parallel durchgeführt werden können. In diesem kleinen Maßstab ist es jedoch schwierig, wichtige Kultivierungsparameter zu überwachen oder zu kontrollieren. Die Zellwachstumsbestimmung in Schüttelkolben erfordert beispielsweise eine Offline-Probennahme. Dies ist ein großer Nachteil, da es das Kontaminationsrisiko und die Arbeitslast erhöht. Darüber hinaus können diese Messungen nur zu bestimmten Zeitpunkten durchgeführt werden, was sie für ein tieferes Prozessverständnis ungeeignet macht. Jetzt wurde eine neue Analyseeinheit - das SFR vario - für die Online-Überwachung des Zellwachstums in Schüttelkolbenkulturen entwickelt. Diese Methode basiert auf der Detektion von Licht, das von Partikeln in der Flüssigkeit gestreut wird. Die Korrelation zu optischer Dichte (OD) und Zelltrockengewicht (CDW) kann durch nichtlineare Kalibrierungsmodelle ermittelt werden. Die für die Zellwachstumsbestimmung verwendeten optoelektronischen Komponenten wurden in das etablierte SFR Shake Flask Reader System implementiert, um eine Überwachungsvorrichtung zu schaffen, die eine simultane pO2-, pH- und Biomasseüberwachung in Schüttelkolbenkulturen ermöglicht. Erste Evaluierungstests mit E. coli K12 als prokaryotische und K. marxianus als eukaryotische Modelle wurden durchgeführt, die hoch reproduzierbare Ergebnisse lieferten.
Material & Methoden
Ein neues zusätzliches Sensormodul zur Bestimmung von Streulicht mit einem Streuwinkel von ca. 360 ° wurde in die Optik für die pO2- und pH-Messung des SFR Shake Flask Readers (PreSens) integriert (Abb. 1). Der von einer LED emittierte Lichtstrahl wird durch den Kolbenboden übertragen und durch Partikel (Zellen) im Kulturmedium gestreut; dieses Streulicht wird von einer Photodiode detektiert (Abb. 1B). Während des Schüttelns bildet sich eine Flüssigkeitssichel im Kolben (Abb. 1B), so dass ein piezoelektrischer Beschleunigungssensor integriert wurde, um den Messzyklus zu optimieren. Er passt die Zeit zwischen den Messungen an. Die Leistungsfähigkeit dieser neuen Analyseeinheit wurde mit zwei Modellorganismen - E. coli K12 und K. marxianus - demonstriert. E. coli wurde in Minimalmedium, das Glukose und Laktose enthielt, bei 37 °C kultiviert, um das diauxische Wachstum zu verfolgen. K. marxianus wurde in YM-Medium mit Glukosemonohydrat bei 30 °C kultiviert. Beide Mikroorganismen wurden in 500 ml-Schüttelkolben mit integrierten pO2- und pH-Sensoren (SFS, PreSens) bei 100 ml Arbeitsvolumen und 150 U/min kultiviert. Alle Kultivierungen wurden viermal unter den gleichen Bedingungen durchgeführt. Drei der Kultivierungen wurden verwendet, um ein Kalibrierungsmodell der Streulichtintensität als eine Funktion von OD600 zu erzeugen. Dafür wurden Offline-Proben alle 60 Minuten unter sterilen Bedingungen entnommen und OD600 wurde bestimmt. Die verbleibende Kultur wurde zur Validierung verwendet. Messungen von Biomasse, pH und pO2 wurden bei einem Messintervall von 15 s durchgeführt.
Online Biomasse-Überwachung
Bevor die Analyseeinheit für das Biomasse-Monitoring eingesetzt werden konnte, musste ein eindeutiger Zusammenhang zwischen Streulicht und Biomassekonzentration für den untersuchten Zelltyp unter den jeweiligen Kultivierungsbedingungen abgeleitet werden. Daher wurden offline OD600-Messungen der Proben mit den jeweiligen Online-Messwerten korreliert. Für E. coli K12 und K. marxianus lässt sich diese Korrelation am besten durch eine vereinfachte Bleasdale-Nelder-Funktion beschreiben:
y = (a + b • x)(-1/c) Formel 1
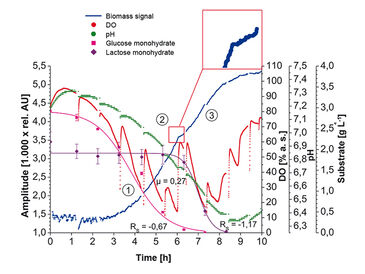
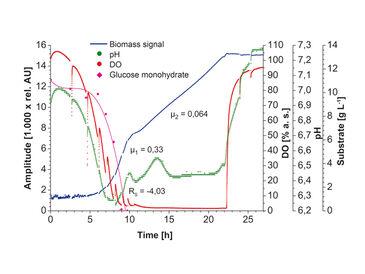
wobei y der OD600-Wert ist, x für die gemessene Lichtintensität steht und a - c die jeweiligen median-gefilterten Parameterwerte sind, die für den spezifischen Zelltyp bestimmt wurden. In den Abbildungen 2 und 3 sind Biomasse-Messungen mit dem Prototyp SFR vario in E. coli K12 und K. marxianus Kultur dargestellt. Zusätzlich werden Sauerstoff- und pH-Messungen sowie offline gemessene Substratkonzentrationen gezeigt. Mit einer Abtastrate von 15 Sekunden wurde eine große Menge an Biomasse-Messdaten erzeugt, was einen sehr guten Echtzeit-Überblick über die Biomasse-Entwicklung gibt. Zu Beginn der Kultivierung wurde in Kulturen beider Mikroorganismen ein gewisses Messrauschen beobachtet. Dies wird durch niedrige Anfangszelldichten und Grenzschichtreflexion des Detektionslichtstrahls an der Mediumoberfläche verursacht. Während die Zellen wuchsen und das Kulturmedium ausreichend trüb wurde, stabilisierten sich die Biomasse-Messungen und begannen zu steigen. Ein Medianfilter wurde angewendet, um die Graphen zu glätten. Die Unterbrechungen der Sauerstoff- und pH-Messungen wurden durch das Stoppen der Schüttelbewegung zur Probenahme für Offline-Messungen verursacht. In Abb. 2 kann das diauxische Wachstum von E. coli eindeutig aus den Meßwerten bestimmt werden, die vom Prototypgerät geliefert wurden. Die Zeit nach Glukoseverbrauch ist durch eine metabolische Umstellung von Glukose zu Laktoseverbrauch gekennzeichnet, die in einem kleinen Plateau in den Biomasse-Messungen beobachtet werden kann. Darüber hinaus konnte die genaue Übereinstimmung von gestopptem Wachstum mit schnell ansteigenden Sauerstoffniveaus sowie einem Plateau in den pH-Messungen aufgezeichnet werden. Die verschiedenen Wachstumsphasen von K. marxianus (Abb. 3) sind auch in den Online-Biomassedaten gut zu erkennen. In der ersten Phase wird Glukose unter aeroben Bedingungen metabolisiert. Wenn Glukose im Medium limitierend wird, schaltet der Zellstoffwechsel um, um die Produkte des vorherigen Glukoseverbrauchs unter hohem Sauerstoffbedarf zu metabolisieren. Die Wachstumsrate in der zweiten Phase ist viel niedriger als in der vorherigen Phase, was in den Biomasse-Messungen deutlich sichtbar ist; aufgrund der Sauerstofflimitierung ist das Wachstum in dieser Phase linear. Mit dem Prototyp SFR vario konnten wir die Entwicklung der Biomasse von eukaryotischen und prokaryotischen Modellorganismen in Schüttelkolben verfolgen und Messergebnisse gewinnen, die noch nie zuvor in Schüttelkolben aufgezeichnet wurden. Mit den Daten, die das SFR vario liefert, können alle relevanten Informationen über Kulturbedingungen ohne die Notwendigkeit einer Offline-Analyse überwacht werden.
Zusammenfassung
Die Funktionalität und das Potenzial des neuen Sensorsystems wurde durch das Online-Monitoring verschiedener Zelltypen erfolgreich demonstriert. Biomasse-Messungen mit dem SFR vario Prototyp können sowohl auf eukaryotische als auch auf prokaryotische Zellsuspensionen angewendet werden. Der Anwendungsbereich des Gerätes zur Online-Messung von pO2, pH und Biomasse ist vielseitig. Individuelle Kalibrierungsmodelle für verschiedene Zelltypen und Kulturbedingungen liefern präzise Vorhersagen der Biomassekonzentration. Die entwickelten Kalibrierungsmodelle für E. coli K12 und K. marxianus zeigten, dass eine hohe Genauigkeit mit einem relativen Fehler von weniger als 12 % im Vergleich zu alternativen Offline-Techniken erzielt werden kann. Durch die Verwendung dieses nicht-invasiven Sensorsystems ist es möglich, Informationen über das Zellwachstum in Schüttelkolben in Echtzeit zu erhalten. Weitere Auswertungen des entwickelten Sensorsystems werden durchgeführt, um es an weitere Mikroorganismen und Zelllinien anzupassen und das Anwendungsspektrum zu erweitern.



