Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Online pH und DO Messungen in Microcarrier-basierten hMSC Kultivierungen
Kulturüberwachung in einem Single-Use Spinner mit integrierten Sensorspots
V. Jossen1, C. Schirmaier1, G. T. John2, D. Eibl1, und R. Eibl1
1Züricher Hochschule für Angewandte Wissenschaften, Life Sciences und Facility Management, Institut für Biotechnologie, Wädenswil, Schweiz
2PreSens Precision Sensing GmbH, Regensburg, Deutschland
Spinner-Flaschen werden oft für Mikrocarrier-basierte Kultivierungen von humanen mesenchymalen Stammzellen (hMSCs) verwendet. Normalerweise sind diese nicht mit pH- und gelösten Sauerstoffsonden ausgestattet. Dieser Applikationsbericht beschreibt zum ersten Mal die Kultivierung von hMSCs in Einweg-Spinner-Flaschen, die mit optischen pH (SP-HP5) und gelöst Sauerstoff (DO, SP-PSt3) Sensoren von PreSens ausgestattet sind. Während eine Peak-Zellzahl zwischen 4,1 × 107 Zellen und 5,9 × 107 Zellen in zwei Kultivierungsläufen erreicht wurde, lieferten die Sensoren zuverlässige DO- und pH-Daten.
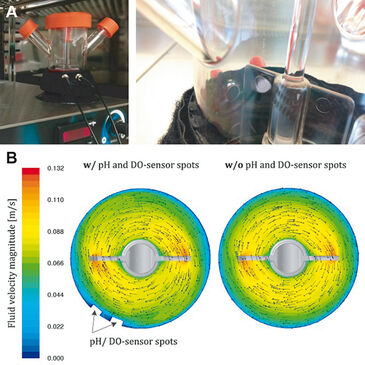
Spinner-Flaschen sind für Kultivierungen von hMSCs im ml-Maßstab gut etabliert [1-3]. Zum Beispiel kann das Screening von Zellkulturmedien, Microcarrier-Arten und Prozessparametern schnell mit Spinner-Flaschen durchgeführt werden [4]. In der Regel sind sie jedoch nicht instrumentiert und erlauben keine Online-Messung wichtiger Prozessparameter wie DO und pH, die einen starken Einfluss auf die Kultivierungsergebnisse haben. Die vorliegende Studie untersucht die Zuverlässigkeit von Sauerstoff- und pH-Werten, die online mit optischen Sensoren von PreSens (Deutschland) während Microcarrier-basierter Expansionen von aus Fettgewebe gewonnenen humanen mesenchymalen Stammzellen (hADSCs) gemessen werden. Die optischen Sensoren wurden an den Innenwänden von 125 ml-Spinner-Flaschen (Corning, USA) angebracht. Die optischen Polymerfasern zur Sensoranregung und dem Auslesen der Sensorantwort wurden gegenüber den Sensorspots mit einem ARC (Adapter für runde Behälter, PreSens) fixiert und mit einem pH-1 mini und OXY-4 mini verbunden (Abb. 1A). Es muss erwähnt werden, dass herkömmliche Sonden wegen des engen Raums zwischen dem Rührer und der Reaktorwand nicht in den verwendeten Spinner-Flaschen installiert werden können. Daher ist die miniaturisierte Größe der Sensorspots im Vergleich zu herkömmlichen Sonden ein großer Vorteil. Darüber hinaus verändern PreSens Single-Use pH- und DO-Sensoren nicht das Fließverhalten des Kulturmediums in der Spinnerflasche (Abb. 1B).
Material & Methoden
Kultivierungen wurden mit kryokonservierten hADSCs durchgeführt, die zweite Passage stammte von einem einzigen Spender, der darüber informiert worden war und zustimmte. Die Zellen wurden von Lonza Cologne GmbH zur Verfügung gestellt und wurden auf kommerziell erhältlichen Polystyrol-Mikrocarriern in einem Serum-reduzierten Medium (5 % FBS) kultiviert, das speziell von Lonza, USA, entwickelt wurde. Parallel zu den instrumentierten Spinnern arbeiteten wir mit Standard-Spinnern (Kontrollspinnern), bei denen keine Sensorspots implementiert waren. Entsprechend den Abtastintervallen wurden Offline-Proben von den Kontrollspinnern genommen. Vor Inokulation mit Zellen wurde 1 g der Polystyrolträger (Wachstumsfläche 360 cm²) in die Spinnerflasche überführt. Anschließend wurde das serumreduzierte, vorgewärmte Kulturmedium zugegeben, um ein Arbeitsvolumen von 115 ml zu erreichen. Die Mikroträger / Medium-Suspension wurde drei Stunden gerührt, um die Sensorspots zu tränken und die Suspension ins Gleichgewicht zu bringen. Danach wurden pH und DO rekalibriert und 1 × 106 Zellen inokuliert. Während der ersten vier Stunden wurde nicht gerührt, um die Zellanhaftung zu fördern. Dann wurde die Kultur bei 60 U/min, 37 °C, 80 % Feuchtigkeit und 5 % CO2 für eine Kulturdauer von 7 bis 8 Tagen gerührt. Dreifache Proben wurden zu verschiedenen Zeitpunkten genommen, um Zelldichten mit dem NucleoCounter NC-100 (Chemometec, Dänemark) zu bestimmen. Die Messungen von Glukose und Laktat wurden mit dem Cedex Bio (Roche Diagnostics, Schweiz) [Daten hier nicht gezeigt] durchgeführt. Zusätzlich wurde der pH-Wert offline gemessen (Mettler Toledo). Der online pH-Wert wurde neu kalibriert, wenn die Offline-Messung eine Abweichung von 0,1 zeigte.
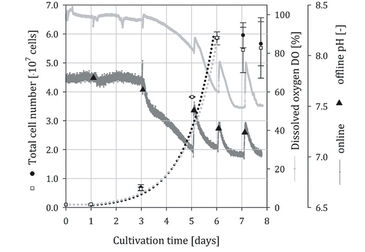
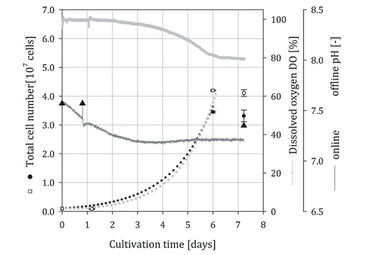
Stammzellkultur in Spinner-Flaschen
In Abb. 2 und 3 sind die zeitabhängigen Profile der Gesamtzellzahlen, pH (online / offline) und DO (online) Messungen für zwei unabhängige hADSC Kultivierungen aufgetragen (Quadrate = optischer Spinner, Punkte = Kontrollspinner). Für alle Kultivierungen wurde eine eintägige Lag-Phase beobachtet. In Kultivierungsversuch 1 wurde am Tag 7 im optischen Spinner eine Peak-Zellzahl von 5,95 x 107 Zellen erreicht. Im Kontrollspinner wurde am Tag 6 eine Peak-Zellzahl von 5,84 x 107 Zellen gemessen. Die simulierten Wachstumskurven zeigen ein vergleichbares Wachstum innerhalb der exponentiellen Wachstumsphase für beide Spinnerflaschen. Die Zellen wuchsen mit einer mittleren Wachstumsrate (μ) von 0,83 d-1 (Verdopplungszeit 20,1 h), vergleichbar mit Ergebnissen früherer Untersuchungen [4]. Nach Erreichen der Peak-Zellzahlen wurde weiteres Zellwachstum vermutlich durch nicht ausreichend zur Verfügung stehende Microcarrier-Oberfläche verhindert. In Kultivierung 1 (Abb. 2) nahm die DO-Konzentration von 100 % auf 52 % ab, wodurch eine spezifische Sauerstoffverbrauchsrate (qO2) von 4,7 x 10-17 mol s-1 pro Zelle berechnet wurde. Im Vergleich zu Literaturdaten (2,50 x 10-17 [5] bis 2,25 x 10-18 mol s-1 pro Zelle [6]) lag die berechnete Sauerstoffverbrauchsrate für die hMSCs im typischen Bereich. Die Online-Messung zeigte, dass die Probenahme am 3., 5., 6., 7. und 8. Tag Auswirkungen auf das Kultivierungssystem hatte. Der Gasaustausch wurde während der Probenahme intensiviert, was zu einem erhöhten DO- und pH-Signal (Signalspitzen) führte. Dennoch zeigten die offline pH-Messungen ähnliche Werte (mittlere Abweichung < 2 %) wie die online Messungen. Die minimale Abweichung zeigt die Zuverlässigkeit der online Messungen. Die Anzahl der Probenahmen in Kultivierung 2 wurde verringert (Tag 0, 1, 6 und 7), um den Gasaustausch zu reduzieren. Dementsprechend wurden glattere Signalkurven für pH und DO, ohne abrupte Peaks, erhalten. Die Peak-Zellzahlen (3,45 x 107 Zellen im optischen Spinner, 4,11 x 107 Zellen im Kontroll-Spinner) in Kultur 2 waren etwa 29 - 42 % niedriger als in Kultur 1. Ein vergleichbares Wachstum mit einer mittleren Wachstumsrate (μ) von 0,65 d-1 entsprechend einer Verdopplungszeit von 25,6 h wurde für den optischen Spinner sowie für seine Kontrolle berechnet. Das reduzierte Zellwachstum zeigte sich auch im DO-Signal, wo eine Abnahme von 21 % (von 100 % auf 79 %) aufgezeichnet wurde. Unter Verwendung der geschätzten spezifischen Sauerstoffverbrauchsrate (qO2) von Kultivierung 1 konnte eine mittlere Zellzahl von etwa 4,14 x 107 Zellen für die Kultivierung 2 vorhergesagt werden.
Zusammenfassung
Diese Ergebnisse zeigen, dass die online DO-Messung verwendet werden kann, um das Zellwachstum in Einweg-Spinner-Flaschen zu beurteilen und vorherzusagen. Darüber hinaus zeigen die online pH-Messungen, dass der reduzierte Gasaustausch eine schnelle Abnahme des pH-Wertes nach der Inokulation bewirkt, was das Zellwachstum beeinträchtigen kann. Die online pH- und DO-Messungen mit den optischen Sensoren von PreSens ermöglichen eine genaue und zuverlässige Messung der beiden wichtigsten Prozessparameter.
Danksagung:
Wir danken dem Team von Dr. Christian van den Bos von Lonza Cologne (Deutschland) für die Bereitstellung der Zellen, Microcarrier, Kulturmedien, und den Wissensaustausch.
Referenzen
[1] D. Schop, et al. (2008), J Tissue Eng Regen Med 4, 126 - 135
[2] S. Kaiser, et al. (2013), Chemie Ing Tech 85, 95 - 102
[3] C. J. Hewitt, et al. (2011), Biotechnol Lett 33 (11), 2325 - 35
[4] C. Schirmaier, et al. (2014), Eng Life Sci
[5] P. Godara (2008), J Chem Tech Biotechnol 420, 408 - 420
[6] Q. a Rafiq, et al. (2013), Biotechnol Lett 35 (8), 1233 - 45


