Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Perfusionskultur von zellbesiedelten 3D-Gerüsten für das Tissue Engineering
Inline Sauerstoffmessung im Perfusionsbioreaktor
R. Santoro, B. Pippenger, I. Martin, und D. Wendt
Department of Surgery and Research, University Hospital, Basel, Schweiz
Da Sauerstoff in Kulturmedium eine geringe Löslichkeit aufweist, muss er den Zellen innerhalb von 3D-Gerüsten über konstante Perfusion des Mediums zugeführt werden. Der Sauerstoffgehalt des Mediums vor und nach dem Passieren der Zellen kann dann helfen zu bestimmen, ob die angewandte Strömungsrate ausreichend ist. PreSens Durchflusszellen mit integrierten chemisch-optischen Sensoren können in den Einlass und Auslass des Konstrukts eingebaut werden und ermöglichen eine Inline-Messung der Sauerstoffspannung. Normoxische Sauerstoffversorgung erzeugt homogene Transplantate mit einer gleichmäßigen Zellverteilung.

Bioreaktoren im Tissue Engineering
Das Tissue Engineering, angesiedelt an der Schnittstelle zwischen Biologie, Chemie und Materialwissenschaften, ist von reiner Spekulation zu einem „Hot Topic“-Forschungsfeld geworden, mit dem Ziel, menschliche Transplantate zu erzeugen, die als autologe Ersatzstoffe für verletztes Gewebe angewendet werden können. Gewebe bestehen aus Zellen in einer 3D-Konformation. Daher ist alles, was mit einer bestimmten Zelle passiert, nicht nur das Ergebnis eines 2D-Austauschs, sondern eine Vielzahl von Wechselwirkungen, von biologischen bis zu mechanischen, die sich alle zu einer spezifischen Botschaft an die Zelle zusammenfügen. Um dieses komplexe System in vitro besser zu reproduzieren und zu verstehen, werden Perfusionsbioreaktoren verwendet. Zur Herstellung homogener Gewebetransplantate können Zellen zunächst in porösen 3D-Gerüsten mit einer gleichmäßigen Verteilung ausgesät werden, wodurch eine Vorlage für eine räumlich einheitliche Abscheidung extrazellulärer Matrix (ECM) erstellt wird. Die in den inneren Bereichen ausgesäten Zellen müssen dann während einer längerdauernden 3D-Kultur mit ausreichenden Nährstoffen versorgt werden, um ihre Lebensfähigkeit aufrechtzuerhalten und die ECM-Produktion zu unterstützen, was unter Umständen die Anwendung eines konvektiven Fluidstroms erfordert. Bestimmte Gewebe haben spezifische Bedürfnisse in Bezug auf Nährstoffversorgung, mechanische Stimulation und Gasversorgung. Zu wissen, welche Umweltbedingungen auf das kultivierte Gerüst einwirken, ist daher von entscheidender Bedeutung.
Spezielle Bioreaktorsysteme
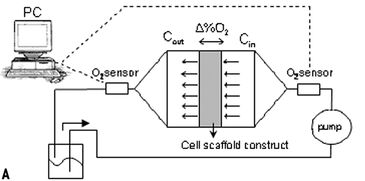
Wir haben bereits im Vorfeld ein integriertes Bioreaktorsystem entworfen, um eine verlängerte Perfusion von Kulturmedium durch 3D-Konstrukte, die ebenfalls über Perfusion mit Zellen besiedelt werden, in einer einzigen Vorrichtung zu ermöglichen. Um den Bereich der Sauerstoffniveaus in den perfundierten Konstrukten kontinuierlich zu überwachen, wurden Inline-Sauerstoffsensoren in den Kultivierungspfad nahe des Ein- und des Auslasses der Konstrukte eingebaut. Aufgrund der niedrigen Frequenz unseres Zellwachstumssignals haben wir uns entschieden, die Sauerstoffspannung im Medium mit einer niedrigen Abtastrate, nur einmal alle 10 Minuten, zu messen.
Kultivierung von HACs in 3D-Gerüsten
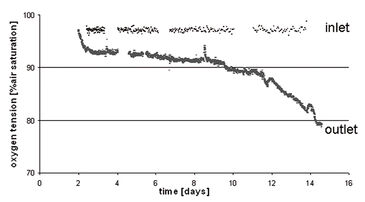
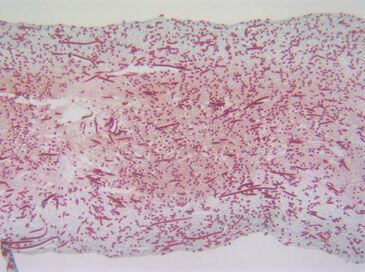
Unter Verwendung des entwickelten Bioreaktorsystems testeten wir dann die Hypothese, dass Zellen, die gleichmäßig in einem 3D-Gerüst ausgesät wurden, ein homogenes Transplantat mit einer gleichmäßigen Verteilung von Zellen und ECM erzeugen, wenn sie durch direkte Perfusion mit normoxischen Sauerstoffniveaus versorgt werden. Die Hypothese wurde unter Verwendung eines Modellsystems mit humane Chondrozyten und einem Schaumgerüst getestet. Adulte humane artikuläre Chondrozyten (HAC) wurden mit einer Rate von 1 mm/s in 4,5 mm dicke Schaumgerüste perfundiert. Um Artefakte (d. h. eine unbeabsichtigte Medien-Reoxygenierung durch Probenahme und Offline-Analyse) zu vermeiden, waren Inline-Sauerstoffsensoren erforderlich. Ein Perfusionssystem für aktuelle Tissue Engineering-Anwendungen stellt jedoch einzigartige Anforderungen an die Sensoren (z. B. geringe Größe, Genauigkeit bei niedrigen Flussraten, Langzeitstabilität), die nicht-traditionelle Sensortechnologien erfordern. Daher wurden PreSens Durchflusszellen mit chemisch-optischen Sauerstoffsensoren, basierend auf Lumineszenslöschung durch Sauerstoff, in die Kultivierungs-Perfusionsschleife eingebaut (Abb. 1, A + B). Die Sensoren verbrauchen keinen Sauerstoff, sind unabhängig von der Durchflussrate und haben gute Langszeitstabilität. Ein Glasfaserkabel übertrug die optischen Signale zwischen dem Sensor und dem Sauerstofftransmitter Fibox 3 (PreSens GmbH, Deutschland). Der Transmitter wurde an einen PC angeschlossen und eine konstante Abtastrate über die Software eingestellt. Die Sensoren wurden direkt am Ein- und Auslass der Gerüstkammer angeschlossen, um eine Sauerstoffdiffusion in das System durch Röhren und andere Komponenten zu verhindern, wie sich in Vorversuchen bei denen Sensoren weiter stromaufwärts / stromabwärts angeordnet waren gezeigt hatte. Mit Stickstoff versetztes Wasser (d. h. mit 0 % Sauerstoff) wurde durch das System perfundiert, um zu zeigen, dass zwischen dem Einlass- und dem Auslasssensor nur eine vernachlässigbare Menge Sauerstoff aus dem Inkubator in den Bioreaktor hinein diffundierte. Der Test zeigte, dass zu jeder Zeit während der gesamten Kultivierungsperiode die am Einlass gemessenen Sauerstoffspannungen in der Nähe des Sättigungspegels blieben (d.h. 95 % Luftsättigung, im Gleichgewicht mit der Inkubatoratmosphäre, eingestellt auf 5 % CO2 - 19 % O2) während am Auslass über 80 % Luftsättigung gemessen wurden (Abb. 2). Diese Daten bestätigten, dass der Bioreaktor bei der verwendeten Flussrate eine effiziente und ziemlich konsistente Sauerstoffversorgung der Zellen innerhalb der perfundierten Konstrukte im Bereich normoxischen Niveaus beibehielt. Eine erfolgreiche Langzeitkultivierung von HAC-Zellen war möglich und mikroskopische Daten zeigten, dass sich ein homogenes Gewebe bildete (Abb. 3).
Zusammenfassung
Durch die Aufrechterhaltung eines normoxischen Sauerstoffniveaus im Bioreaktorsystem war es möglich, HAC für lange Zeit zu kultivieren und ein homogenes Gewebe mit einer gleichmäßigen Verteilung von lebensfähigen Zellen und knorpeliger extrazellulärer Matrix zu erzeugen. Bei Betrachtung des Eingangssignals stellten wir fest, dass die Sensoren bei unserer Abtastrate nicht beeinträchtigt wurden und selbst in Langzeitmessungen keine Drift zeigten. Die Durchflusszellen mit integrierten Sauerstoffsensoren waren ein nützliches Werkzeug zur Überwachung der Sauerstoffversorgung in der Perfusionskultur. Das optosensorische System von PreSens lieferte verlässliche Ergebnisse und könnte in Zukunft zur Verbesserung des Tissue Engineering beitragen.