Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Simultane Überwachung von pH und Oxygenierung in Mikrovolumina von Blut
Faseroptische pH Mikrosensoren und Miniatur-Breitbandspektrophotometrie verbessern die Blutfunktionsanalyse
Michael Oellermann, Hans-Otto Pörtner, und Felix C. Mark
Alfred Wegener Institut, Helmholtz-Zentrum für Polar- und Meeresforschung, Bremerhaven, Deutschland
Die Implementierung eines pH Mikrosensors und eines Miniatur-Breitbandspektrophotometers in einer Gasdiffusionskammer erleichterte die pH-abhängige Analyse der Blutsauerstoffbindungseigenschaften. Parallele Aufzeichnungen von pH-Werten und Pigmentabsorption in Mikrovolumina von ungepuffertem Blut bei Gefriertemperaturen ergaben hochaufgelöste Sauerstoffgleichgewichtskurven.
Seit mehr als einem Jahrhundert entwickeln und verfeinern Forscher Geräte, um die komplexe Physiologie des Sauerstofftransports zu erfassen und zu verstehen, was eine Vielzahl an derzeit angewandten Methoden hervorgebracht hat [1]. Trotz des technologischen Fortschritts müssen aber immer noch methodische Herausforderungen bewältigt werden, insbesondere, wenn Biologen Umwelteinflüsse auf nicht modellhafte Organismen untersuchen. Hier ein paar Beispiele derartiger Herausforderungen:
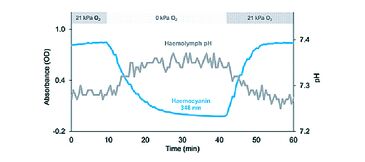
(1) Die Analyse der Blutsauerstoffbindung erfordert die Kontrolle oder Überwachung verschiedener Faktoren wie Temperatur, Kohlendioxid und insbesondere pH. Der pH-Wert variiert jedoch mit Veränderungen der Blutpigmentoxygenierung aufgrund von Protonenaufnahme oder -freisetzung durch das Pigment selbst (Abb. 1). Hinzugefügte Puffer stabilisieren den pH-Wert während der Experimente, können jedoch relevante Reaktionen des Sauerstofftransports auf solche pH-Änderungen, wie sie in vivo auftreten, maskieren oder verzerren [2]. Ein umfassendes Verständnis des Sauerstofftransports erfordert daher die Überwachung des Blut-pH-Werts gleichzeitig mit der Pigmentoxygenierung in ungepuffertem Blut [3].
(2) Häufig sind Probenvolumina aufgrund der kleinen Organismusgröße, problematischer Blutgefäße oder der Entnahme von Teilproben aus lebenden Exemplaren auf nur wenige Mikroliter begrenzt. Dennoch verbrauchen viele Geräte große Probenvolumina (> 400 μl) bei jeder Messung, auch aufgrund der erhöhten Volumenanforderungen durch herkömmliche pH-Elektroden, was wiederum die Anzahl experimenteller Replikationen oder gemessener Parameter einschränkt.
(3) Bei niedrigen Versuchstemperaturen (< 5 ºC) arbeiten herkömmliche pH-Elektroden aufgrund von instabilen und langsam ansprechenden Signalen sehr schlecht, was die Blutfunktionsanalyse von z. B. polaren Organismen erschwert.
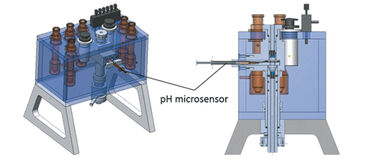
Um diese Herausforderungen zu meistern, haben wir eine von Niesel und Thews [4] sowie Sick und Gersonde [5] entworfene und beschriebene Gasdiffusionskammer (Eschweiler Co., Kiel, Deutschland) mit einem PreSens pH Mikrosensor und einem Miniatur-Breitbandspektrophotometer ausgestattet.
Material & Methoden
Technische Modifikationen
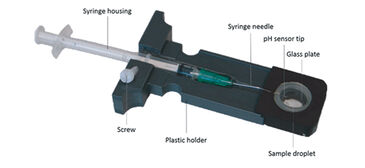
Gasdiffusionskammern werden häufig verwendet, um die Blutsauerstoffbindung von winzigen Blutproben zu bestimmen, indem Änderungen der Extinktion bei charakteristischen Wellenlängen als Reaktion auf sich ändernde Konzentrationen von Sauerstoff, Kohlendioxid und Stickstoffgas überwacht werden. Wir modifizierten eine Gasdiffusionskammer: (1) durch Anschließen eines digitalen Miniatur-Breitbandspektrophotometers und einer Deuterium-Halogen- (d.h. UV- und sichtbares Licht) Lichtquelle (Ocean Optics, Deutschland) über Glasfaserkabel und Kollimationslinsen direkt über und unter der Blutprobe, um den Lichtstrahl durch das Probentröpfchen zu richten; (2) und durch Einführen eines pH - Mikrosensors (PreSens, Deutschland) wie folgt (Abb. 2): Das Spritzengehäuse des pH - Mikrosensors wurde durch Fräsen eines zylindrischen Kanals in den Probenglashalter eingepasst und mittels Plastikschraube fixiert (Patentnummer 10 2013 011 343 bei DPMA, Abb. 3). Die Stahlnadel, die den Sensor bedeckt, wurde leicht gebogen (ca. 160 ° Winkel), um den Eintritt der Sensorspitze in das Tröpfchen sicherzustellen. Die Nadel wurde dann durch einen Silikonring eingeführt und die Sensorspitze in den Rand des Probentröpfchens bewegt, um übermäßiges Sensorbleichen durch den Lichtstrahl zu vermeiden. Durch den Silikonring konnte der pH-Mikrosensor in die gasdichte Kammer eindringen, ohne ein Gasleck zu verursachen.
Blutfunktionsanalyse
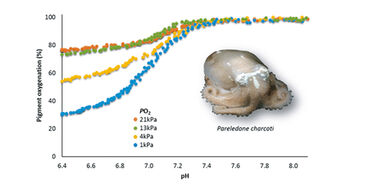
Eine Blutfunktionsanalyse wurde an zellfreier Hämolymphe von antarktischen Oktopoden durchgeführt, die auf der Fahrt der RV Polarstern im März 2012 gesammelt wurde. Vor jeder Messung wurde der pH-Mikrosensor in sechs mit 40 mmol L-1 MOPS ( 3- (N-Morpholino) propansulfonsäure) gepufferten Meerwasserstandards (pH 6,7 - 8,1) bei 0 ° C kalibriert und der pH-Wert mit Tris-gepuffertem Meerwasserstandard (Dickson, CO 2 QCLab, USA) auf den frei skalierbaren pH korrigiert. Die Hämolymphe wurde auf Eis aufgetaut, mit 0,8 µl 0,2 mmol L-1 NaOH (10 µmol L-1 Endkonzentration) gemischt, um den pH auf über 8,0 zu erhöhen, und davon 15 µl auf die Glasplatte gegeben. Um die Sauerstoffgleichgewichtskurven zu kalibrieren, wurde die maximale Absorption bei 100% Sauerstoff aufgezeichnet und die minimale Extinktion durch Regressionsanalyse berechnet [6]. Die Messungen wurden bei konstantem Sauerstoffpartialdruck (pO2, 21, 13, 4, 1 kPa) und bei kontinuierlich abnehmendem Kohlendioxidpartialdruck / pH (pCO2, 0 - 10 kPa / ca. pH 8,1 - 6,8) durchgeführt.
Absorption und pH-Messungen von ungepuffertem Oktopoden-Blut
Mit Hilfe der modifizierten Gasdiffusionskammer konnten wir die pH-abhängige Oxygenierung von Hämocyanin antarktischer Oktopoden in nur Mikrovolumina ungepufferter Hämolymphe analysieren (Abb. 4). Die kontinuierliche und gleichzeitige Aufzeichnung von Absorption und pH bei nur mittleren Aufzeichnungsintervallen (eine Messung pro 30 s) führte zu hochaufgelösten Sauerstoffgleichgewichtskurven. Der kleine Sondendurchmesser des pH Mikrosensors von 150 µm ermöglichte das vollständige Eintauchen der Sondenspitze in das 15 µl Probentröpfchen. Ein Verklumpen von Protein an der Sensorspitze und damit eine Signalstörung traten bei Oktopodenblut aufgrund fehlender Hämostase nicht auf. Im Gegensatz zu pH-Elektroden lieferten pH-Mikrosensoren stabile pH-Messungen mit schneller Ansprechzeit bei 0 ° C Versuchstemperatur (Abb. 4). Die Pigmentoxygenierung nahm sigmoidal zu niedrigerem pH-Wert ab, was die pH-Abhängigkeit der für Kopffüßler-Hämocyanin typischen Oxygenierung unterstreicht [3]. Das Blut antarktischer Okotopden zeigte eine hohe Sauerstoffaffinität bei 0 ° C, die durch unvollständige Sauerstoffentladung bei niedrigem pH und niedrigen Sauerstoffpartialdrücken gekennzeichnet war (4).
Zusammenfassung
Mit der Implementierung eines PreSens pH-Mikrosensors und eines Miniatur-Breitbandspektrophotometers in einer Gasdiffusionskammer konnten die aktuellen methodischen Herausforderungen der funktionellen Blutanalyse bewältigt werden, mit denen vor allem Biologen zu kämpfen haben, die die pH-Empfindlichkeit der Pigmentoxygenierung in winzigen Volumina ungepufferten Blutes untersuchen möchten. Wiederholte Messungen entlang von pH-Gradienten können bei verschiedenen Sauerstoffpartialdrücken und Temperaturen durchgeführt werden, und das auch in Blut von Tieren, die nur begrenzte Probenvolumina liefern, ohne dass verschiedene Proben zusammengefasst werden müssen. Simultane und kontinuierliche Aufzeichnungen von pH und Extinktion verbesserten die Datenauflösung erheblich und ermöglichten eine detailliertere Analyse der Sauerstoffbindungskurven. Stabile und schnell reagierende pH-Signale bei Gefriertemperaturen erleichterten die Blutfunktionsanalyse eines antarktischen Oktopoden, dessen Blutpigment Hämocyanin eine hohe Sauerstoffaffinität aufwies. Zukünftig könnten auch pO2- oder pCO2-Mikrosensoren implementiert werden, um konventionelle, aber hoch aufgelöste Sauerstoffbindungsexperimente entlang eines pO2-Gradienten durchzuführen oder pH-unabhängige Effekte der CO2 -Bindung an Blutpigmente zu bewerten.
Referenzen:
[1] Oellermann M., Pörter, H.-O. and Mark, F. C. (2014). J. Exp. Biol. 217, 1430 - 1436
[2] Brix, O., Colosimo, A. and Giardina, B. (1994). Mar. Freshw. Behav. Physiol. 25, 149 - 162
[3] Pörtner, H.-O. (1990). J. Exp. Biol. 150, 407
[4] Niesel, W. and Thews, G. (1961). Pflügers Archiv 273, 380 - 395
[5] Sick, H. and Gersonde, K. (1969). Anal. Biochem. 32, 362 - 376
[6] Oellermann, M., Pörter, H.-O. and Mark, F. C. (in Vorbereitung). Blue blood on ice: Modulated blood oxygen transport facilitates cold adaptation and eurythermy in an Antarctic octopod