Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Zellsauerstoffverbrauch in Mikrofluidikvorrichtungen
Überwachung der Sauerstoffspannung mit dem VisiSens-System
Christopher Ochs1, Junichi Kasuya2 und Andrea Pavesi1
1Singapore MIT Alliance for Research and Technology, BioSystems and Micromechanics, Singapur
2MechanoBiology Laboratory, Department of Biological Engineering, Massachusetts Institute of Technology, MA, USA
Wir haben Mikrofluidikvorrichtungen, die aus Cycloolefin-Copolymer (COC) und Polydimethylsiloxan (PDMS) hergestellt wurden, mit VisiSens-Sensorfolien kombiniert, um eine Überwachung der Sauerstoffspannung in den Vorrichtungen zu ermöglichen. Der Sauerstoffverbrauch von mikrovaskulären Endothelzellen aus Rattenlungen (EC) und Rattenhepatozyten (Hep) wurde numerisch simuliert und experimentell unter Verwendung des VisiSens-Aufbaus validiert. Das VisiSens-System erlaubte die Bestimmung des Sauerstoffgehalts in den Mikrofluidikvorrichtungen, sodass geeignete Chip-Materialien - je nach Anwendung und verwendeter Zelllinie – empfohlen werden können. Darüber hinaus wurde ein zuvor charakterisierter mikrofluidischer Hypoxie-Chip evaluiert, wobei VisiSens im Vergleich zu ähnlichen Produkten überlegene Sensorik-Eigenschaften zeigte.
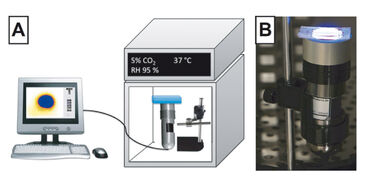
In den letzten Jahren haben sich Mikrofluidikvorrichtungen als vielseitige Plattformen etabliert, um bestimmte Gewebe-Mikroumgebungen nachzuahmen und zelluläres Verhalten und Signalgebung zu untersuchen. Aufgrund ihrer optischen Transparenz, Biokompatibilität und einfachen Herstellung werden für gewöhnlich Vorrichtungen, die auf Polydimethylsiloxan (PDMS) basieren, für Untersuchungen im Labormaßstab verwendet. Aber PDMS zeigt nachteilige Eigenschaften hinsichtlich der Adsorption kleiner hydrophoben Spezies. Jüngste Berichte, die die Sauerstoffverteilung und -manipulation untersuchen, zeigen wachsendes Interesse an Zellkultur unter hypoxischen oder anoxischen Bedingungen. Hier bieten unter anderem Hartkunststoff-Vorrichtungen aus Cycloolefin-Copolymer (COC), Polystyrol (PS) oder Polypropylen (PP) eine sauerstoffundurchlässige Alternative und lassen sich auch leicht in großen Mengen produzieren. Es ist jedoch wenig über den Sauerstoffverbrauch von Zellen während der Kultur in derartigen Vorrichtungen und die mögliche Auswirkung auf die Lebensfähigkeit / das Verhalten der Zellen bekannt. Daher wurde die Sauerstoffspannung in mikrofluidischen Bauteilen aus COC und PDMS mit VisiSens überwacht, um deren Eignung für die Zellkultur zu beurteilen. Darüber hinaus wurde ein zuvor veröffentlichter Hypoxie-Chip mit der VisiSens-Technologie evaluiert. Die VisiSens-Detektoreinheit (DU01, PreSens) wurde vertikal in einem variablen Inkubator montiert und die Mikrofluidikvorrichtung (die mit Sensorfolien verbunden und mit Kollagengelen und Zellen gefüllt war) darauf platziert (1). Der Sauerstoffverbrauch der Zellen wurde über mehrere Stunden mit der VisiSens-Software überwacht.
Material & Methoden
Hochdurchsatz-COC- und PDMS-Chips, mit einer langen Gelregion und angrenzenden, separaten Medienkanälen, wurden entworfen und hergestellt. Ein neuartiger Hypoxie-Chip, der auf PDMS basiert, wurde ebenfalls getestet. Dieser Chip besteht aus einem zentralen Gelbereich, der von verbundenen Medienkanälen und peripheren Gaskanälen flankiert ist, wobei die Gaskanäle durch eine dünne sauerstoffdurchlässige PDMS-Membran physisch von den Medienkanälen getrennt sind. Direktes Verbinden der unbehandelten Sensorfolien (SF-RPSU4, PreSens) mit den Chips erzeugte mechanisch instabile Konstrukte oder schlecht versiegelte Vorrichtungen. Es wurde beschlossen, eine dünne Schicht (30 μm) PDMS durch Spin-Coating auf Sensorfolien mit entfernter Schutzbeschichtung aufzutragen, da PDMS bekanntermaßen gut sowohl an PDMS als auch an COC bindet. Die PDMS-beschichteten Folien wurden dann irreversibel mit aktivierten COC- und Plasma-behandelten PDMS-Chips verbunden, wodurch die mikrofluidischen Kanäle gut abgedichtet waren. Die Funktionalität der Sensorfolien wurde nach PDMS-Beschichtung, Härtung und Plasmabehandlung überprüft und es wurde kein signifikanter Leistungsunterschied im Vergleich zu unbehandelten Folien festgestellt. Um die Zelladhäsion zu erleichtern, wurden die Vorrichtungen dann mit Poly-D-Lysin (1 mg/ml in dH20) beschichtet. Ein 2,5 mg/ml Typ-I-Kollagengel wurde in die Gelregion der Chips eingebracht. Unmittelbar vor dem Aussäen der Zellen wurden die Medienkanäle für 4 Stunden mit einer 50 ng/ml wässrigen Lösung von Fibronectin gefüllt. In der vorliegenden Studie wurden mikrovaskuläre Rattenendothelzellen (EC) und Rattenhepatozyten (Hep) verwendet. Beide Zelltypen wurden in den Medienkanälen der Chips mit einer Dichte von 4 M Zellen/ml ausgesät und für 30 Minuten stehengelassen, damit sie sich festsetzen konnten. Unbefestigte Zellen wurden dann mit frischem Medium ausgewaschen und die Vorrichtungen für die angegebenen Zeiträume in einem variablen Inkubator (5% CO2, 37 °C) kultiviert. Der Sauerstoffverbrauch in den Vorrichtungen in Gegenwart von EC- und Hep-Zellen wurde ebenfalls unter Verwendung kommerzieller Finite-Elemente-Software (COMSOL Multiphysics v4) simuliert. Alle Messungen wurden mit der VisiSens AnalytiCal 1 Software ausgewertet.
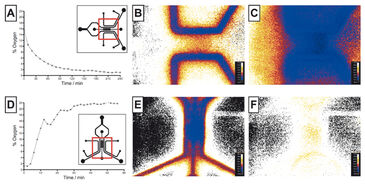
Sauerstoffspannung im Hypoxie-Chip
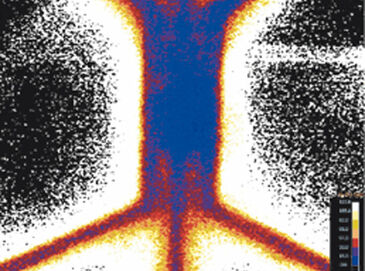
Der neuartige Mikrofluidik-Chip, der in der Lage ist, einheitliche oder hypoxische Gradientenzustände über einer zentralen Zellregion zu etablieren, wurde getestet, um die VisiSens-Technologie mit anderen Sauerstoffsensoren zu vergleichen. Der Hypoxie-Chip war mit Kollagen und Wasser gefüllt. Eine On-Chip-Kalibrierung wurde erreicht, indem zeitweilig eine luftgesättigte und eine sauerstofffreie (Sulfit-)Lösung in die Gaskanäle gepumpt wurde. Anschließend wurden die Gaskanäle mit Stickstoffgas durchspült, um einheitlich hypoxische Bedingungen zu schaffen. Die Sauerstoffkonzentration im Gelbereich wurde über die Zeit gemessen (Abb. 2 B). Die Sauerstoffspannung senkte sich innerhalb von 1,5 h auf 3 % und innerhalb von 4 h auf 1 % ab. Im Vergleich zu früheren Daten stimmt dieses Ergebnis besser mit den numerischen Simulationsdaten überein (3 % nach einer Stunde), was das Potenzial des VisiSens-Systems für die Anwendung in Mikrofluidiken aufzeigt. Dann wurde der Hypoxie-Chip mit sauerstofffreier (Sulfit-)Lösung gefüllt und Luft wurde durch die Gaskanäle geleitet, um den umgekehrten Effekt zu demonstrieren. Abbildung 2 C zeigt die Reoxygenierung der zentralen Gelregion von 1 % Hypoxie auf 21 % O2 nach ca. 1 Stunde. Sauerstoffgradienten konnten ebenfalls mit VisiSens ermittelt und ausgewertet werden.
Zellsauerstoffverbrauch
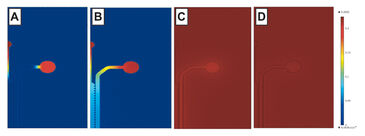
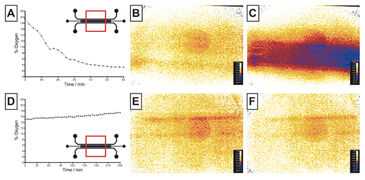
Vor der Auswertung wurde der Sauerstoffverbrauch von Hep und EC sowohl in COC- als auch in PDMS-Chips simuliert (Abb. 3). Für die Modellierung wurde die gleiche Zellaussaatdichte wie bei der experimentellen Validierung verwendet. Die Simulationsergebnisse zeigen, dass für Hep im COC-Chip eine Sauerstofflimitierung wahrscheinlich ist (0 % nach 0,5 h), ein hoher Verbrauch für EC in COC zu erwarten ist (6 % nach 2 h) und von normalen Sauerstoffwerten für Hep und EC in PDMS (21 %) ausgegangen werden kann. Beide Zelllinien wurden unabhängig voneinander in Mikrofluidik-Chips ausgesät, über 2 Tage kultiviert, und ihr Sauerstoffverbrauch mit dem VisiSens-System überwacht, bis sich ein Gleichgewichtszustand eingestellt hatte. Hepatozyten zeigten einen hohen Sauerstoffverbrauch und verbrauchten nahezu den gesamten Sauerstoff innerhalb des undurchlässigen COC-Chips innerhalb von 1 h (3 %, Fig. 4 A - C), was mit den Simulationsergebnissen vergleichbar ist. In dünnen PDMS-Chips kann Sauerstoff aus der Umgebung eindringen, was zu einer Stabilisierung des Sauerstoffgehalts zwischen 15 und 17 % innerhalb von 4 Stunden führte (Abb. 4 D - F). Diese Ergebnisse unterscheiden sich signifikant von den simulierten Werten, was auf konservative Simulationsparametern zurückzuführen sein können. Diese Daten legen nahe, dass COC-Vorrichtungen für eine hypoxische Zellkultur von Hepatozyten geeignet sind, während PDMS-Vorrichtungen mit definierter Dicke gewählt werden sollten, wenn ein intermediärer Sauerstoffgehalt der Kultur erwünscht ist. Für ECs wurde nur ein mäßiger Sauerstoffverbrauch erwartet, was sowohl durch die Simulationen als auch experimentelle Daten bestätigt wurde, die in Zellkulturen in Chips mit Sensorfolie gemessen wurden. Es wurde kein signifikanter Unterschied zwischen COC (stabil um 21 - 19 %) und PDMS (21 %) beobachtet und beide Materialien können daher für die normoxische Kultur dieser Zelllinie als geeignet angesehen werden.
Zusammenfassung
Ein zuvor charakterisierter mikrofluidischer Hypoxie-Chip konnte erfolgreich evaluiert werden, und das VisiSens-System zeigte im Vergleich zu ähnlichen Produkten überlegene sensorische Fähigkeiten. Die Biokompatibilität und nicht-invasive Arbeitsweise der VisiSens-Sensorfolien ermöglichte auch die Bestimmung des Sauerstoffgehalts in mikrofluidischen Zellkulturen, und erlaubt es je nach verwendeter Zelllinie geeignete Chip-Materialien (COC oder PDMS) zu empfehlen. Mikrofluidikvorrichtungen, die mit Sauerstoffsensoren ausgestattet sind, sind vielversprechende Kandidaten für Screening-Studien und hypoxische Zellkulturanwendungen.