Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Zellwachstum und Produktion rekombinanter Proteine in kleinen Kulturgefäßen
Optische Sauerstoff-Sensorspot helfen bei der Optimierung von Kulturbedingungen
V. Jäger1, G. Apati1,2, und N. Konisch1
1Recombinant Gen Expression Group, Helmholtz Zentrum für Infektionsforschung, Braunschweig, Deutschland
2Universidade da Região de Joinville, Brasilien
Optische Sauerstoffmessung erlaubt es kleine Sensorspots in Kulturgefäße zu integrieren. Da viele der konventionellen Sub-Bioreaktor-Kulturgefäße nicht mit polarographischen Sauerstoffsonden kompatibel sind, ist diese Technologie ein wertvolles Werkzeug für die Online-Überwachung in kleinformatigen Kulturen. PreSens Sauerstoff-Sensorspots wurden zusammen mit dem 4-Kanal-Sauerstoffmessgerät OXY-4 mini zur Überwachung von Erlenmeyer- und Fernbach-Schüttelkolben sowie Spinnerflaschen eingesetzt. Die Messung von Sauerstoffkonzentrationen in Kulturen von entweder Sf21- und High Five™-Insektenzellen in Kombination mit dem Baculovirus-Expressionsvektorsystem lieferte wichtige Informationen über optimale Füllvolumina in den kleinen Gefäßen und half dabei, die metabolische Zellaktivität während der Kultivierung zu verfolgen.
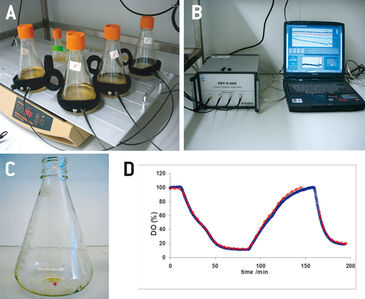
Herkömmliche polarographische Sauerstoffsonden, die üblicherweise zur Prozessüberwachung von Tierzellen in gerührten Bioreaktoren eingesetzt werden, sind in Anzuchtgefäßen kleinerer Größe sehr schwierig anzuwenden. Aufgrund ihrer Größe und des rein invasiven Messverfahrens können sie nicht in Gefäßen ohne ausreichenden Zugang, wie z. B. in Spinnern oder Schüttelkolben, installiert werden. Optische Sensoren hingegen sind ideal für die Sauerstoffüberwachung in diesen kleinen Zellkulturgefäßen. Die chemisch-optischen Sensorspots, die nicht größer sind als ein paar Millimeter, können in die Kulturgefäße integriert werden, und die Sensorantwort wird von außen - durch die transparente Gefäßwand - über Lichtwellenleiter ausgelesen. Dieser nicht-invasive Ansatz ermöglicht nicht nur eine einfache Sauerstoffüberwachung in kleineren Zellkulturen, sondern verringert auch das Kontaminationsrisiko. In dieser Studie wurden die PreSens Sauerstoff-Sensorspots zusammen mit dem OXY-4 mini - einem 4-Kanal-Sauerstoffmessgerät - für Prozessoptimierungsexperimente mit Kulturbehältern im Sub-Bioreaktor-Maßstab eingesetzt, d. h. Erlenmeyer- und Fernbach-Kolben sowie Spinnerflaschen. Kulturen in solchen Gefäßen werden üblicherweise über die Oberfläche des Kulturmediums belüftet. Sauerstoffversorgung und damit Stoffwechselaktivität und Wachstum der Zellen können z. B. durch Ändern der Rotationsgeschwindigkeit oder Verwendung von Schikanen beeinflusst werden. Dies setzt jedoch die Zellen einer höheren mechanischen Belastung aus, und bei höheren Füllvolumina ist die Zunahme des Sauerstofftransfers begrenzt. Daher ist es von großer Wichtigkeit, die Sauerstoffkonzentrationen in kleinen Anzuchtbehältern zu überwachen. Hier wird die Anwendbarkeit der optischen Sauerstoffüberwachung in Kulturen von Sf21- und High Five™-Insektenzellen in Kombination mit dem Baculovirus-Expressionsvektorsystem gezeigt.
Material & Methoden
Erlenmeyer-Kolben (125 ml, 500 ml und 1000 ml) und Fernbach-Kolben (3000 ml) mit Membrankappen (Corning) sowie Techne-Spinner-Kolben (Nennfüllvolumen von 125 ml oder 500 ml) wurden mit Sauerstoff-Sensorspots (SP-PSt3, PreSens) ausgestattet und für verschiedene Optimierungsexperimente verwendet. Optische Fasern, die an ein 4-Kanal-Sauerstoffmessgerät (OXY-4 mini, PreSens) angeschlossen waren, wurden an den Kolben mit Klettstreifen (ARC, PreSens) gegenüber den Sensorspots angebracht, um das Signal auszulesen (Abb. 1 A + B). In einem Vorversuch wurde der Sauerstoffmesswert der optischen Sensorspots mit Messungen einer polarographischen Sauerstoffsonde (Mettler Toledo) verglichen. IPLB-Sf21 AE- und High Five™-Zellen wurden in Ex-Cell 420-Medium (SAFC Biosciences) kultiviert. Zusätzlich zum Online-Sauerstoffmonitoring wurden Zellzahlen (Hämozytometer, Tryptanblau-Ausschluss), Zellgrößenverteilung (CASY-Zellzähler TTC, Roche), Glukose- und L-Lactat-Konzentrationen (YSI 2700-Analysator), GFP-Fluoreszenz (Guava EasyCyte Durchflusszytometer), und PIGF-1 (Sandwich-ELISA) bestimmt und die Ergebnisse mit den Sauerstoffwerten verglichen [1].
Sauerstoffüberwachung in kleinformatiger Zellkultur
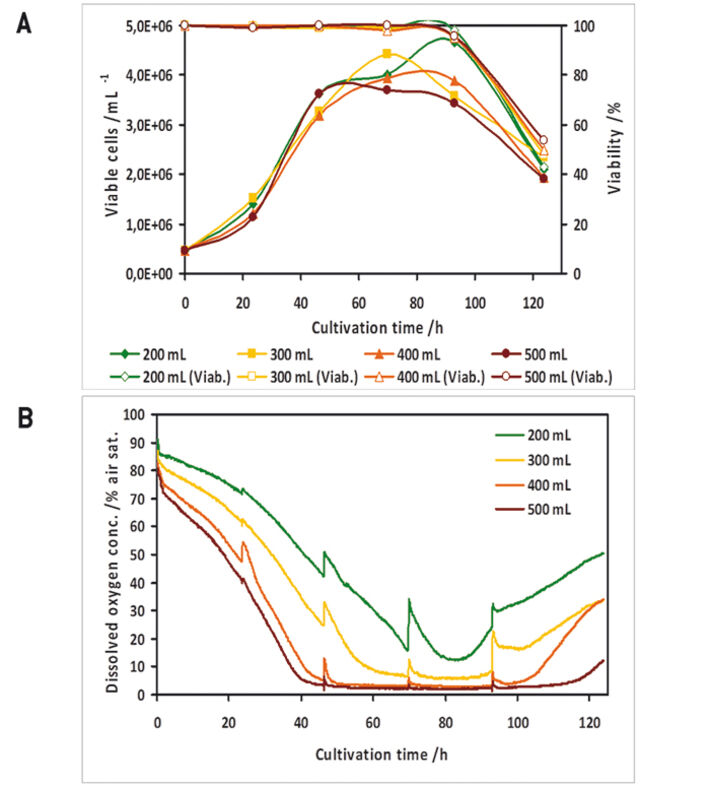
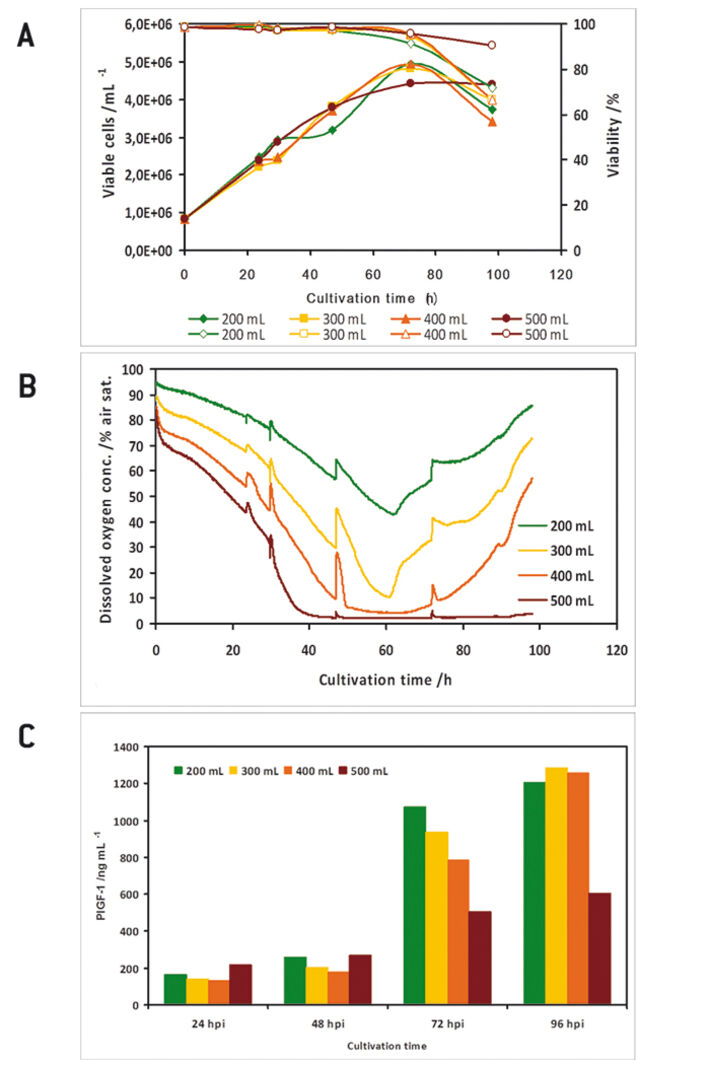
In einem Vorversuch zeigten die optischen O2-Sensoren in den Kolben eine gute Übereinstimmung mit Messungen einer polarographischen Sauerstoffsonde (Abb. 1 D). Alle Experimente wurden mit zwei parallelen Kulturen durchgeführt, wobei eine Kultur keinen Sauerstoffsensor enthielt, da in dieser Studie nur vier Kanäle für das Auslesen der Sensoren zur Verfügung standen. High Five™ Insektenzellen wurden bei verschiedenen Füllvolumina in 1000 ml Schüttelkolben kultiviert. In den Kulturen mit höheren Füllvolumina trat eine Sauerstofflimitierung auf (Abb. 2 B). Beim Vergleich der Wachstumskinetik der Kulturen mit den Sauerstoffwerten zeigten sauerstofflimitierte Kulturen eine reduzierte maximale Zelldichte (Abb. 2 A). Analyseergebnisse der Wachstums- und Expressionskinetik von Baculovirus-infiziertemn IPLB-Sf21-AE in 1000 ml-Schüttelkolben zeigten, dass sauerstofflimitierte Bedingungen (Füllvolumina von 400 und 500 ml) nur eine geringe Wirkung auf das Sf21-Zellwachstum hatten (Abb. 3), die Produktion des rekombinanten Proteins wurde aber entweder verzögert oder allgemein reduziert. Die Lebensfähigkeit der Zellen konnte jedoch unter sauerstofflimitierten Bedingungen besser aufrechterhalten werden. Dies könnte durch eine Hemmung des viralen Replikationszyklus verursacht worden sein. Hier erlaubten die Online-Sauerstoffmessungen die Identifizierung der aktuellen Phase der Baculovirusinfektion und zeigten mögliche Prozesseinschränkungen auf. Weitere Experimente wurden in 125 ml Schüttelkolben durchgeführt (Daten nicht gezeigt).
Zusammenfassung
Die optischen Sauerstoffsensoren zeigten eine sehr gute Langzeitstabilität. Die Sensoren wurden wiederholt über mehr als ein Jahr verwendet (Daten nicht gezeigt). Die Technologie erwies sich als wertvoll für Prozessoptimierungsexperimente, wie zum Beispiel das Identifizieren geeigneter Füllvolumina für die Expression von rekombinantem Protein in Spinner- oder Schüttelkolben. Zusätzlich können Online-Messungen von Sauerstoffkonzentrationen verwendet werden, um metabolische Zellaktivitäten über die zelluläre Aufnahme von Sauerstoff zu beurteilen, was eine Vorhersage der Leistung einzelner Expressionsexperimente ermöglicht.
Applikationsbericht nach
[1] V. Jäger, G. Apati, N. Konisch, wissenschaftliches Poster, 21st ESACT-Meeting, Dublin 2009: Optimisation of cell growth and recombinant protein production in small-scale culture vessels by using optical sensors for on-line measurement of dissolved oxygen.


