Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Eine mikrofluidische Plattform zur nicht-invasiven Echtzeitüberwachung von Mikroglia-Polarisation
Anwendung neuartiger optischer SensorPlugs für die Mikrofluidik
Elifsu Polatli1,2, Alperen Yilmaz1,3, Resul Özbilgiç1,2, Íbrahim H. Erbay1,2, Duygu Sağ1,2,4, Sinan Güven1,2,4,*
1Izmir Biomedicine and Genome Center, Izmir, Türkei
2Dokuz Eylul Universität, Izmir International Biomedicine and Genome Institute, Izmir, Türkei
3Universität von Ankara, Department of Biomedical Engineering, Izmir, Türkei
4Dokuz Eylul Universität, School of Medicine, Izmir, Türkei
* Korrespondierender Autor: sinan.guven@ibg.edu.tr
In dieser Studie stellten wir die Hypothese auf, dass Sensorsysteme für die nicht-invasive Echtzeitüberwachung des Mikroglia-Metabolismus verwendet werden können, um die Polarisationsniveaus in Richtung eines bestimmten Phänotyps in einer dynamischen Mikroumgebung genauer zu untersuchen. Wir haben einen Mikrofluidik-Chip entworfen und hergestellt, um Mikroglia unter kontinuierlicher Perfusion zu kultivieren und Änderungen von Sauerstoff und pH mit dem Polarisationszustand bei Aktivierung zu korrelieren.
Eine Entzündung ist eine komplexe Reihe von Ereignissen, die durch Reize wie fremde Antigene, Krankheitserreger und Chemikalien ausgelöst werden. Sie spielt eine Schlüsselrolle bei verschiedenen Krankheiten wie Autoimmunerkrankungen, Krebs und Wundheilungsprozessen [1]. Makrophagen und Mikroglia spielen aufgrund ihrer Antigenpräsentation, Phagozytose und Immunmodulationseigenschaften eine wichtige Rolle bei Entzündungen bzw. Neuroinflammationen [2]. Mikroglia als Subtyp von Makrophagen wirken auch wie Makrophagen bei der neuralen Immunantwort [3]. Mikroglia können sich je nach den Signalen, denen sie in ihrer physiologischen Mikroumgebung ausgesetzt sind, in zwei verschiedene Phänotypen mit den Namen M1 und M2 verwandeln [4]. Proinflammatorische M1-Mikroglia, auch als "klassisch aktiviert" bezeichnet, können durch Lipopolysaccharid (LPS) induziert werden, während IL-4 und IL-13 den "alternativ aktivierten" entzündungshemmenden M2-Phänotyp induzieren [5,6]. In Reaktion auf die Stimulation in Richtung eines M1-Phänotyps wurde gezeigt, dass metabolische Veränderungen in Makrophagen und Mikroglia auftreten. Während der LPS-Stimulation hemmt das erzeugte Stickoxid (NO) die oxidative Phosphorylierung, wodurch die Zellen auf Glykolyse umschalten. Aufgrund dieser Reaktion steigt die Laktatproduktion an, was wiederum die extrazelluläre Ansäuerungsrate (ECAR) erhöht. Die Überwachung der Veränderungen des pH-Werts gibt Aufschluss über den physiologischen und metabolischen Zustand von Zellen und Geweben [7]. Der Polarisationszustand von Mikroglia kann herkömmlicherweise durch Genexpression, Zelloberflächenmarker und Proteine nachgewiesen werden, die an das Kulturmedium abgegeben oder in der extrazellulären Matrix akkumuliert werden. In dieser Hinsicht gehören PCR, Durchflusszytometrie, ELISA und Western Blot zu den häufigsten Methoden, die allerdings invasiv, mühsam und zeitaufwändig sind. Diese Techniken bieten auch keine Einblicke und keine Echtzeitüberwachung über Änderungen der Polarisationszustände während In-vitro-Experimenten. Mikrofluidische Organ-on-a-Chip-Systeme bieten hervorragende In-vitro-Plattformen zur Nachahmung komplexer Organe / Gewebe, indem sie hierarchische 3D-Architekturen mit dynamischen Kulturmodellen für heterogene Zellpopulationen bereitstellen. Es wurde bereits über ein Neuroinflammationsmodell für Krankheiten mit komplexer Ätiologie berichtet, das die Vorteile biotechnologisch hergestellter Mikroumgebungen weiter hervorhob [8].
Material & Methoden
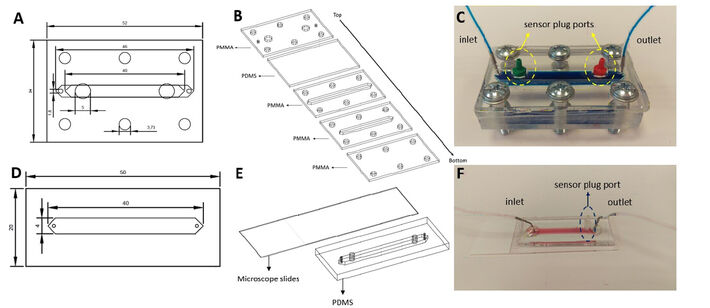
Mikrofluidik-Chips wurden aus Polydimethylsiloxan (PDMS) hergestellt, wegen dessen Flexibilität, wodurch das Einsetzen von SensorPlugs und das Abdichten erleichtert wird. Um die PDMS-Komponenten der Chips zu erzeugen, wurde PDMS auf Polymethylmethacrylat (PMMA) -Formen mit einer 1:10 Mischung aus Härter bzw. PDMS gegossen. Nach dem Entgasen unter Vakuum wurden die Formen eine Stunde lang bei 80 ºC gebacken und die Chips aus den Formen herausgeschnitten. Chip A ist ein Hybridchip, der PMMA- und PDMS-Komponenten enthält. Der untere Teil des Chips enthält einen Kanal für die 3D-Kultur und den Flüssigkeitsfluss mit einer PDMS-Schicht über diesen Schichten mit Einlass-, Auslass- und SensorPlug-Anschlüssen. Eine zusätzliche PMMA-Schicht umschließt den Chip, um den Glasfaserkabeln eine strukturelle Unterstützung zu bieten, und das Festziehen der Schrauben erleichtert. Alle diese Schichten wurden mit Hilfe von 6 Schrauben miteinander verbunden (Abb. 1C). Chip B hat zwei Schichten. Nach Lithographie wurden die hergestellten PDMS-Komponenten an Objektträger plasmagebunden. Nach dem Verkleben wurden diese Chips 2 Stunden lang auf eine 120 °C-Heizplatte gelegt, um die Bindungsstärke zu verbessern.
Eine N9-Maus-Mikroglia-Zelllinie wurde für Makrophagenpolarisationsexperimente verwendet. Für die Zellexpansion wurde RPMI-Komplettmedium (phenolfrei) 1640 (ergänzt mit 10% fötalem Rinderserum (FBS) und 1% Penicillin / Streptomycin (Pen / Strep)) verwendet. Die Zellen wurden bis zu einer Konfluenz von 80 % kultiviert und mit 0,25 % Trypsin-EDTA geerntet. Mit Ethanol sterilisierte Chips wurden mit hoher Zelldichte (4,5 × 105 Zellen/cm2) ausgesät und über Nacht bei 37 °C und 5% CO2 unter statischen Bedingungen inkubiert.
Sobald die Mikroglia-Zellen anhafteten und eine Monoschichtkultur bildeten, wurde ein kontinuierlicher Fluss von 0,5 µl/min mit einer Spritzenpumpe (Harvard Apparatus) angelegt (Abb. 2). Mikroglia-Zellen wurden mit 300 ng/ml Lipopolysaccharid (LPS) 24 Stunden lang in einen M1-ähnlichen Phänotyp polarisiert. Nicht stimulierte Zellen wurden während der gesamten Studie als Kontrollgruppe verwendet. Mikrofluidik-Chips wurden in einen Zellkultur-Inkubator gegeben und die SensorPlugs wurden mit den Glasfaserkabeln verbunden. Sauerstoff- und pH-Sensormessungen wurden 24 Stunden lang gesammelt. Während der Datenerfassung wurde der Inkubator nicht geöffnet, um Gas- und Temperaturschwankungen zu vermeiden.
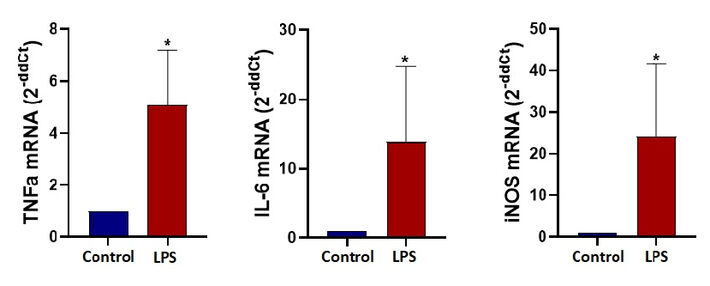
Nach 24 Stunden dynamischer Kultur in Mikrofluidik-Chips wurde ein Lysepuffer mit 15 uM Dithiothreit (DTT) in den Kanal pipettiert, um die Zellen zu lysieren. Das Lysat wurde gesammelt und zur RNA-Isolierung bei - 80 ºC gelagert. RNAs wurden mit dem Macherey-Nagel RNA Isolations-Kit isoliert. Kontroll- und M1-Gruppen wurden gemäß ihren TNFα-, IL-6- und iNOS-Genexpressionsniveaus mit qPCR-Analyse verglichen.
Der Überstand, der während der 24-stündigen Inkubation aus den Auslässen von Mikrofluidik-Chips gesammelt wurde, wurde für ELISA verwendet. Der Affymetrix eBioscience Mouse TNFα-Kit wurde gemäß den Anweisungen des Herstellers verwendet. Um unsere Sensorwerte zu validieren und die M1-Polarisation zu bestätigen, bestimmten wir die von Kontroll- und M1-Gruppen freigesetzten TNFα-Spiegel.
Ergebnisse
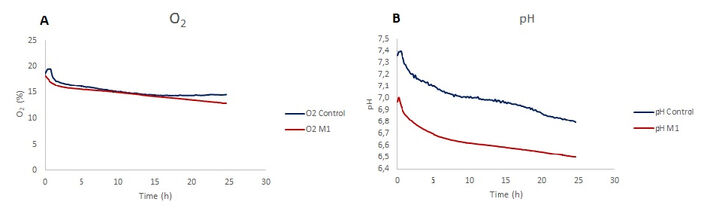
Gelöster Sauerstoff zeigte eine Abnahme bei den LPS-stimulierten Mikroglia und der nicht stimulierten Kontrollgruppe. Während es zu Beginn für beide Bedingungen einen ähnlichen Trend gibt, sind die Sauerstoffwerte für M1-polarisierte Mikroglia in 24 Stunden Stimulationsperiode niedriger als für die Kontrolle. Die Abnahme der gelösten Sauerstoffniveaus der Kontrolle beträgt 22,2 % und 29,5 % für LPS-stimulierte Zellen (Fig. 3A). In pH-Überwachungschips nimmt der pH-Wert über einen Zeitraum von 24 Stunden ab, wobei der Endwert für die Kontrolle 6,8 und für LPS-stimulierte Zellen 6,5 beträgt.
Die Genexpressionsanalyse am Ende der 24 Stunden für TNFα, IL-6 und iNOS zeigt eine signifikante Faltungsänderung, die die M1-Polarisation für LPS-stimulierte Mikroglia-Zellen unter dynamischer Mikrofluidikkultur bestätigt. Ein ELISA-Test zeigt den signifikanten Anstieg des TNFα-Cytokins, das aus LPS-stimulierten Zellen (M1) freigesetzt wird. Die TNFα-Konzentrationen nach 24 Stunden unter dynamischen Bedingungen wurden mit 102 pg/ml für die nicht stimulierte Kontrolle und 470 pg/ml für LPS-stimulierte Mikroglia-Zellen gemessen.
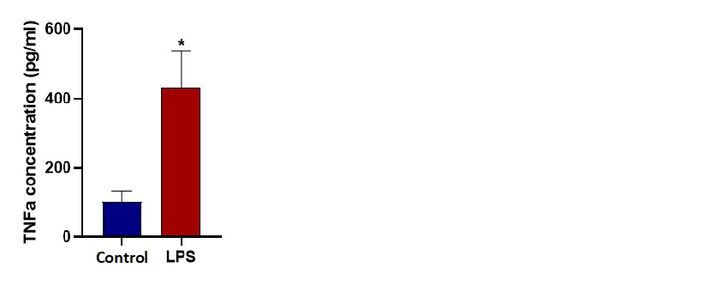
Diskussion
Das ursprüngliche Ziel dieser Studie war es, metabolische Veränderungen zu beobachten, die in Mikroglia während der Polarisation in 3D-Kultur stattfinden. Zu diesem Zweck haben wir Chip A für die dynamische 3D-Kultur entworfen und hergestellt und Zellen in Richtung M1-Phänotyp stimuliert. Wir haben beobachtet, dass Zellen in 3D-Kultur im Vergleich zu 2D-Kultur nicht effektiv polarisiert sind. Wir schließen daraus, dass die geringe Anzahl erfolgreich polarisierter Zellen möglicherweise nicht ausreicht, um die gesamten Stoffwechselmessungen zu ändern. Um die Stärke des neuartigen Sensorsystems in mikrofluidischen Studien zu demonstrieren, konzentrierten wir uns auf konventionellere 2D-Kulturen und verglichen die Ergebnisse mit vorhandender Literatur. Aus diesem Grund haben wir uns für eine dynamische 2D-Monoschichtkultur in einem Mikrofluidik-Chip entschieden. Diese Ergebnisse führten auch dazu, dass wir den mikrofluidischen Chip A gegen Chip B austauschten. Nach 24 Stunden Stimulation stellten wir den Erfolg der M1-Polarisation durch qPCR-Analyse sicher. Die mRNA-Expressionsniveaus der typischen M1-Zustandsmarker TNFα, IL-6 und iNOS waren signifikant höher als bei der Kontrollgruppen. Als nächstes zeigten wir, dass stimulierte Zellen den Translationsprozess von der mRNA auf die Proteinebene tatsächlich abgeschloßen hatten. Zu diesem Zweck haben wir die Mengen an sekretiertem TNFα-Protein im Auslass des Mikrofluidik-Chips mittels eines ELISA bestimmt.
pH-Änderungen stimmten mit der Literatur überein: In mehreren früheren Studien wurde gezeigt, dass die M1-Polarisation eine Verringerung der pH-Werte verursacht, da die stimulierten Zellen eine höhere ECAR aufweisen. In unserer Studie konnten wir im Vergleich zum Kontrollchip im LPS-stimulierten Chip viel niedrigere pH-Werte beobachten. Aber als wir uns die anfänglichen pH-Werte der Chips anschauten, waren sie unterschiedlich. Dies könnte an der Blasenbildung im Mikrokanal liegen. Die Blasen können die Konzentration des gelösten Gases im Medium der Chips beeinflussen und gelöste Gase können den pH-Wert des Mediums verändern. CO2 beeinflusst das Medium durch Verringern des pH-Werts. Wenn das Medium dagegen sauerstoffreichem Gas ausgesetzt wird, steigt der pH-Wert des Mediums an. Wenn das Kontrollmedium O2-reichen Blasen ausgesetzt wurde, könnte dies die höheren pH-Werte erklären. Es gibt noch eine weitere Möglichkeit den Unterschied zu erklären. Das Einrichten des Experiments und das Starten der Messungen dauerte etwa 40 Minuten. Die Zellen wurden vor Beginn der Messungen stimulierenden Faktoren ausgesetzt. Die LPS-stimulierten Zellen könnten den pH-Wert des Mediums durch die iNOS-Bildung nach der Stimulation senken [7].
Die O2-Spiegel stimmten nicht mit der Literatur überein: Die LPS-Stimulation von N9-Mikroglia-Zellen verringert die Proliferationsrate und verändert den Zellstoffwechsel, um Glykolyse-abhängig zu werden. Diese Veränderungen im Zellstoffwechsel führen zu einem geringeren Sauerstoffverbrauch und in Kombination mit einer relativ geringeren Zellzahl aufgrund eines Zellzyklusstillstands [9] ist zu erwarten, dass die Messungen des gelösten Sauerstoffgehalts von LPS-stimulierten Zellen im Vergleich zu Kontrollen höher sind und über die 24-Stunden-Stimulation einen zunehmenden Trend aufweisen. Unsere Ergebnisse zeigen eine um 7% stärkere Abnahme des Sauerstoffgehalts von LPS-stimulierten Zellen. Weitere Experimente müssen durchgeführt werden, um besser zu verstehen, warum diese Nichtübereinstimmung mit der Literatur auftritt.
Referenzen:
[1] Kumar, V., Abbas, A. K., Fausto, N., & Aster, J. C. (2014). Robbins and Cotran pathologic basis of disease, professional edition e-book. Elsevier health sciences.
[2] Fujiwara, N., & Kobayashi, K. (2005). Macrophages in inflammation. Current Drug Targets-Inflammation & Allergy, 4(3), 281-286.
[3] Shi, H., Wang, X. L., Quan, H. F., Yan, L., Pei, X. Y., Wang, R., & Peng, X. D. (2019). Effects of betaine on LPS-stimulated activation of microglial M1/M2 phenotypes by suppressing TLR4/NF-κB pathways in N9 cells. Molecules, 24(2), 367.
[4] Sica, A., Larghi, P., Mancino, A., Rubino, L., Porta, C., Totaro, M.G., Rimoldi, M., Biswas, S.K., Allavena, P. and Mantovani, A., 2008, October. Macrophage polarization in tumour progression. In Seminars in cancer biology (Vol. 18, No. 5, pp. 349-355). Academic Press.
[5] Gordon, S. (2003). Alternative activation of macrophages. Nat. Rev. Immunol. 3, 23–35.
[6] Mantovani, A., Sica, A., & Locati, M. (2005). Macrophage polarization comes of age. Immunity, 23(4), 344-346.
[7] Orihuela, R., McPherson, C. A., & Harry, G. J. (2016). Microglial M1/M2 polarization and metabolic states: Microglia bioenergetics with acute polarization. British Journal of Pharmacology, 173(4), 649–665.
[8] Park, J., Wetzel, I., Marriott, I., Dréau, D., D’Avanzo, C., Kim, D. Y., Tanzi, R. E., et al. (2018). A 3D human triculture system modeling neurodegeneration and neuroinflammation in Alzheimer’s disease. Nature Neuroscience, 21(7), 941–951.
[9] Ferreira, I. A., Porterfield, J. Z., Gupta, R. K., & Mlcochova, P. (2020). Cell Cycle Regulation in Macrophages and Susceptibility to HIV-1. Viruses, 12(8), 839.