Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Aufschluss über die Sauerstoffabhängigkeit von biolumineszenten TNT-aufspürenden E. coli K12 MG1655
Hochauflösende Sauerstoffmessungen mit einem optischen Blankfaser-Mikrosensor und OXY-1 ST
Chritian Ude1, Gernot T. John2, Marc Prante1, Rachel Rosen3, Shimshon Belkin3, Thomas Scheper1
1Institut für Technische Chemie, Gottfried Wilhelm Leibniz Universität Hannover, Hannover, Deutschland
2PreSens Precision Sensing GmbH, Regensburg, Deutschland
3University of Jerusalem, Edmond J. Safra Campus, Givat Ram, Jerusalem, Israel
Vergrabenes explosives Material, das TNT enthält, ist ein ernstes Sicherheitsrisiko für Menschen und Tiere. Zusätzlich machen das hohes toxisches Potential und die schädlichen Auswirkungen auf die Umwelt deutlich, wie wichtig es ist TNT und seine Derivate aufzuspüren und zu entsorgen. Es ist möglich, einen genetisch modifizierten E. coli K12 MG1655 Bakterienstamm zu verwenden, um 2,4-Dinitrotoluol (DNT) nachzuweisen, das ein Abbauprodukt von TNT ist, und sogar durch versiegelte Behälter nach außen dringen kann [1]. Dieser Stamm ist in der Lage Luciferase zu produzieren und emittiert nach DNT-Exposition Biolumineszenz. Für eine effektive Anwendung dieses Bakterienstammes in Biosensoren muss zunächst die Abhängigkeit von externen Parametern beurteilt werden. Durch den Einsatz des OXY-1 ST und eines optischen Blankfaser-Mikrosensors konnte Sauerstoff als der wichtigste Parameter für die Luciferase-Biolumineszenzreaktion innerhalb der Zellen identifiziert und die kritische Konzentrationen bestimmen werden. Darüber hinaus konnten Sauerstofflimitierung und die maximale Dicke eines mit immobilisierten Bakterien beladenen Hydrogels mit hoher räumlicher Auflösung untersucht werden, um die Biosensorentwicklung zu verbessern.
In Kombination mit dem implantierbaren Sauerstoff-Mikrosensor IMP-PSt7 ermöglicht das OXY-1 ST die Messung von gelöstem Sauerstoff in extrem kleinen Volumina mit einer Nachweisgrenze von 0,03 % O2. Die optischen Sauerstoff-Mikrosensoren basieren auf einer 230 μm Quarzfaser und ihre Sensorspitze hat einen Durchmesser von < 50 μm. Wir haben die Leistung dieses Geräts in zwei Anwendungen getestet:
1. Sauerstoffmessung in Quarzglasküvetten während Biolumineszenzmessungen
Zu diesem Zweck mussten mehrere Sensoren und eine Belüftungsdüse in die Küvette eingeführt werden, ohne das Detektionsfenster für Biolumineszenzmessungen mit einem Fluoreszenzspektrometer zu beschatten.
2. Messung von Sauerstoffgradienten in mit Bakterien beladenen Agarose-Hydrogelen
Für die zweite Aufgabe musste gelöster Sauerstoff in Abständen von 50 μm gemessen werden. Dazu brauchten wir einen Sauerstoffsensor mit hoher räumlicher Auflösung.
Sauerstoffüberwachung in der Quarzglasküvette
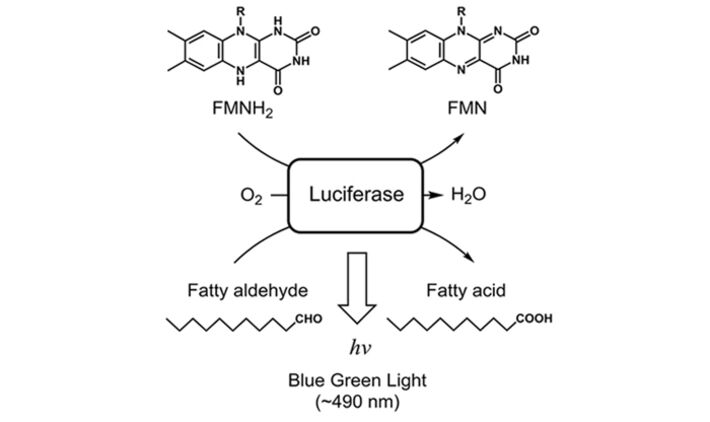
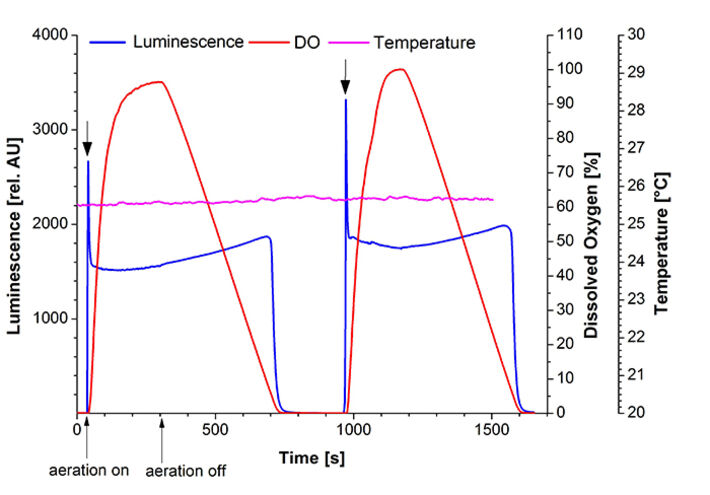
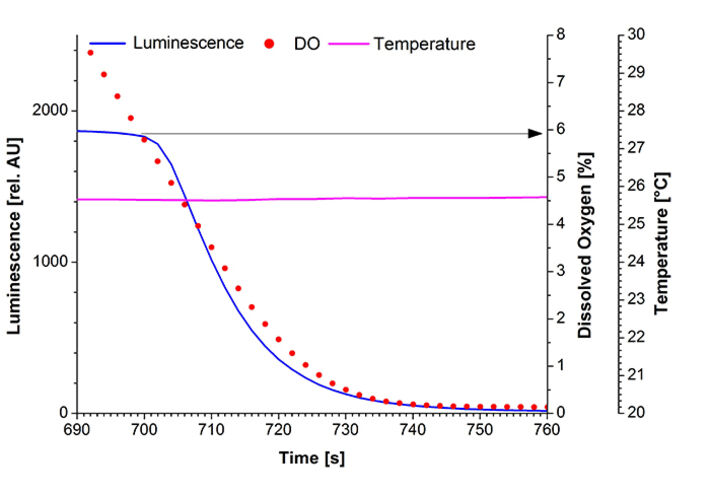
Zur Bestimmung der Luciferase-Parameterabhängigkeiten wurde eine Standard-Quarzglas-UV-Küvette mit einem Pt100 Sensor und dem implantierbaren Sauerstoff-Mikrosensor IMP-PSt7, der mit dem OXY-1 ST verbunden war, ausgestattet. Eine Spritzennadel wurde eingeführt, um die Sauerstoffkonzentration in der Flüssigkeit zu steuern (Abb. 1). Die Küvette wurde in einem Fluoreszenzspektrometer (Hitachi F-7000) fixiert, um die Gesamtbiolumineszenz bei λ = 480 nm zu messen. E. coli K12 MG1655 wurde in 500 ml Schüttelkolben mit Schikanen (100 ml LB-Medium bei 180 U/min, 37 °C) kultiviert. Die Luciferase-Produktion wurde unter Verwendung von 100 mg/l 2,4-DNT während der exponentiellen Wachstumsphase induziert. Die Zellen wurden 3 Stunden nach der Induktion geerntet, auf eine optische Dichte von OD600 = 5 standardisiert und in eine Quarzglasküvette überführt. Während der Messsungen wurde die Temperatur konstant bei 25,6 °C gehalten. Wie in den gelöst Sauerstoff-Messungen (DO) zu sehen ist, stand den Zellen zu Beginn des Experiments kein Sauerstoff zur Verfügung, und unter diesen Bedingungen wurde keine Biolumineszenz emittiert (Abb. 3). Nach 34 s wurde die Sauerstoffzufuhr mit einer Flussrate von 5 ml/min eingeleitet. Innerhalb von Sekunden erhöhte sich die Biolumineszenz auf ein Maximum von 2665 AU. In den folgenden Minuten blieb die Lumineszenz konstant bei 1500 AU, während DO einen Maximalwert von 96 % Luftsättigung erreichte. Zu diesem Zeitpunkt wurde die Sauerstoffzufuhr abgeschaltet, um die kritische Konzentration für den Luciferase-Mechanismus weiter zu untersuchen. Nach 700 s Messung begann die Biolumineszenz schnell abzunehmen (Abb. 4). An diesem Punkt konnte ein kritisches DO-Niveau von 6 % Luftsättigung bestimmt werden, welches notwendig ist, um die von den Bakterien emittierte Biolumineszenz aufrecht zu erhalten. In einem zweiten Teil der Messung (t > 900 s) wurde das Experiment wiederholt und zeigte das gleiche Verhalten. Diese Sauerstoffabhängigkeit wird auch durch das in Abbildung 2 dargestellte Reaktionsschema der Luciferase unterstützt.

Messung von Sauerstoffgradienten in Bakterien-beladenen Agarosegelen
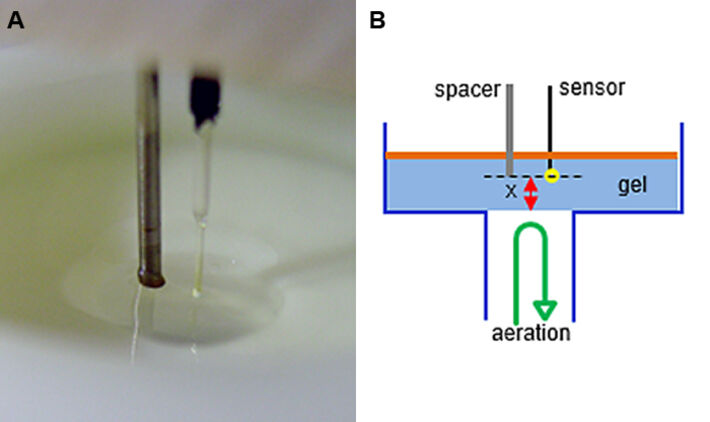
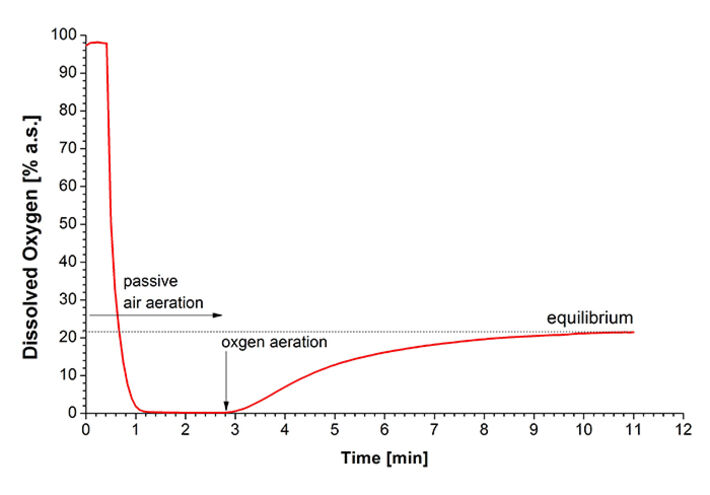
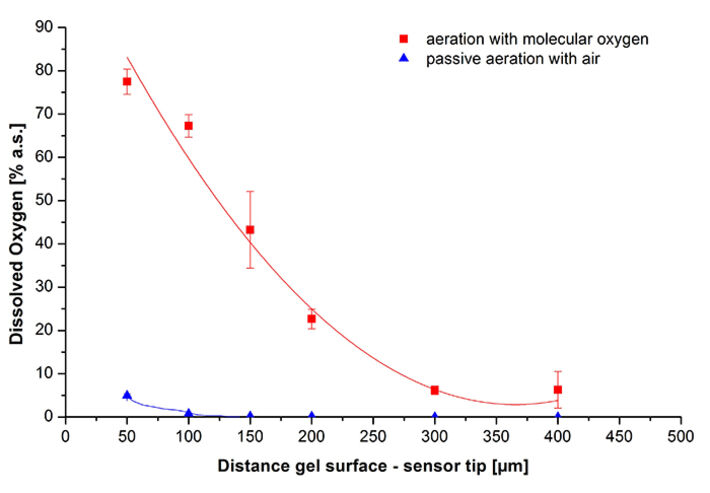
Da festgestellt wurde, dass die Sauerstoffversorgung für die Luciferasefunktion entscheidend ist, befasste sich der nächste Teil der Studie mit Sauerstoffgradienten in mit Bakterien beladenen Agarosegelen. Zu diesem Zweck wurde der Sauerstoff-Mikrosensor IMP-PSt7 in eine Mikromanipulatoreinheit eingespannt (Abb. 5). Mit dieser Vorrichtung konnte der Mikrosensor genau auf die Nullposition in einer zylindrischen Gussform ausgerichtet werden (Abb. 6). Das Bodenloch in der Form wurde als Luft- / Sauerstoffzufuhrkanal verwendet und wurde zum Gießen mit einem Metallstab verschlossen. Zellen zur Immobilisierung wurden in der exponentiellen Wachstumsphase geerntet, in frisches Medium überführt und mit geschmolzenem Agarose-Hydrogel gemischt, um eine endgültige OD600 von 5 und einen Agarosegehalt von 1 % (Gew./Vol.) zu erhalten. Diese Mischung wurde in die Form mit dem voreingestellten Mikrosensor IMP-PSt7 gegossen, um 2 mm dicke Hydrogele herzustellen. Nach der Polymerisation bei 25 °C wurden die Gele mit Paraffinöl bedeckt. Um Gasaustausch zu ermöglichen, wurde das Bodenloch entweder mit Sauerstoff oder Luft belüftet. Als ein Beispiel zeigt Abb. 7 eine DO-Messung mit Gel-immobilisierten Bakterien in einem Abstand von 200 µm von der Geloberfläche zur Sensorspitze. Nach Beginn der Messung kam esaufgrund der Atmung innerhalb einer Minute zu einer schnellen DO-Abnahme von 100 % auf 0 %. In dieser Tiefe war mit passiver Belüftung kein Sauerstoff nachweisbar, so dass die Wachstumsbedingungen einer Sauerstofflimitierung unterlagen. Nach 2,8 Min. wurde die Belüftung mit molekularem Sauerstoff mit 10 ml/min begonnen, um die Sauerstoffversorgung zu verbessern. Ein Gleichgewicht von 22 % konnte nach 11 Min. erreicht werden. Diese Analysen wurden verwendet, um Sauerstoffgradienten bei beiden Belüftungsbedingungen zu bestimmen (Abb. 8). Es konnte gezeigt werden, dass passive Belüftung mit Luft nicht ausreicht, um bei jeder getesteten Eindringtiefe den zuvor ermittelten kritischen Sauerstoffgehalt von 6 % Luftsättigung zu erreichen. Durch Belüftung mit reinem Sauerstoff war es möglich, für eine OD600 = 5 eine ausreichende Sauerstoffkonzentration sowohl für die Atmung als auch für die Luciferasereaktion bis zu 400 μm bereitzustellen. Das heißt, Gelscheiben können bis zu 800 μm dick gegossen werden, um ausreichend Sauerstoff für alle immobilisierten Zellen bereitzustellen.

Zusammenfassung
Unsere Experimente mit dem OXY-1 ST zur biophysiologischen Stamm-Charakterisierung von immobilisierten E. coli K12 zeigten, dass dieses Gerät mit dem IMP-PSt7 Mikrosensor präzise in räumlich eingeschränkten Umgebungen messen kann. Die hohe räumliche Auflösung ermöglichte es, Sauerstoffgradienten in Hydrogelen in Schritten von 50 μm präzise aufzulösen. Die schnelle Reaktionszeit (t90 < 3 s) ermöglicht die Überwachung schneller Veränderungen der Sauerstoffkonzentrationen, was bei der Untersuchung von Enzymreaktionen erforderlich sein kann. Da der Mikrosensor selbst keinen Sauerstoff verbraucht, eignet er sich besonder für die Überwachung von Veränderungen bei sehr niedrigen Sauerstoffkonzentrationen.
Applikationsbericht nach
Prante M., Ude C., et al.: A Portable Biosensor for 2,4-Dinitrotoluene Vapors. Sensors (2018), 18, 4247
Referenzen:
[1] Yagur-Kroll, S., Lalush, C., Rosen, R. et al., Escherichia coli bioreporters for the detection of 2,4-dinitrotoluene and 2,4,6-trinitrotoluene. Appl Microbiol Biotechnol (2014), 98, 885 - 895
[2] Prante, M., A Bioluminescence Biosensor for 2,4-Dinitrotoluene, Masterarbeit, Institut für Technische Chemie, Leibniz Universität Hannover, 30.09.2017



