Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Auswirkungen von Sauerstoffmangel auf die GDH-Aktivität
Sauerstoffüberwachung in geschüttelten Kulturen von C. glutamicum und C. diphtheriae
M. Böhme und A. Burkovski
Lehrstuhl für Mikrobiologie, FAU Erlangen-Nürnberg, Deutschland
In Kulturen von Corynebacterium glutamicum und zwei verschiedenen Stämmen von Corynebacterium diphtheriae wurde der Einfluss von Sauerstoffmangel unter verschiedenen Kultivierungsbedingungen untersucht. Experimente wurden durchgeführt, um den Einfluss niedriger Sauerstoffkonzentrationen auf ein bestimmtes Enzym des Stickstoff-Stoffwechsels zu charakterisieren - das Ammonium-transferierende Enzym Glutamat-Dehydrogenase (GDH). Die Sauerstoffüberwachung wurde mit dem Sauerstoffmessgerät Fibox 3 von PreSens durchgeführt. Die Wachstumsraten in allen getesteten Corynebacterium-Kulturen waren von der Sauerstoffversorgung abhängig und stiegen, je mehr Sauerstoff verfügbar war. Die untersuchte Aktivität von GDH schien durch niedrige Sauerstoffkonzentrationen in C. glutamicum nicht beeinflusst zu werden. In Kulturen von C. diphtheriae erhöhte sich die GDH-Aktivität unter bestimmten Bedingungen, jedoch konnten nur sehr niedrige Aktivitätswerte bestimmt werden, die möglicherweise nicht signifikant sind.
Die Assimilation von Ammonium, das als bevorzugte Stickstoffquelle von C. glutamicum bekannt ist, wird hauptsächlich mittels NADPH-abhängiger Glutamat-Dehydrogenase (GDH) erreicht. Das Enzym wandelt Ammonium in L-Glutamat um, was GDH zu einem biotechnologisch wichtigen Enzym macht, da Glutamat in großen Mengen als Geschmacksverstärker in der Lebensmittelindustrie benötigt wird. Ein Ziel ist es daher, die Effizienz von GDH zu verbessern. In aeroben Bakterien wie C. glutamicum und C. diphtheriae kann eine Sauerstofflimitierung den Stoffwechsel beeinflussen und auch die GDH-Aktivität beeinträchtigen. In früheren Arbeiten von T. Müller [2] konnte eine verminderte Transkription von gdh in C. glutamicum unter Sauerstoffausschluss beobachtet werden. Die folgenden Experimente wurden durchgeführt, um den Einfluss von Sauerstoffmangel auf die Wachstumsrate, die GDH-Aktivität und die gdh-Transkription in Kulturen von C. glutamicum und C. diphtheriae weiter zu untersuchen. Dabei testeten wir verschiedene Kulturbedingungen mit unterschiedlichen Kulturvolumina und Schüttelgeschwindigkeiten. Zur nicht-invasive Sauerstoffüberwachung in den Kulturen über die gesamte Versuchsdauer hinweg wurde ein Fibox 3 zusammen mit chemisch-optischen Sauerstoffsensoren verwendet.
Material & Methoden
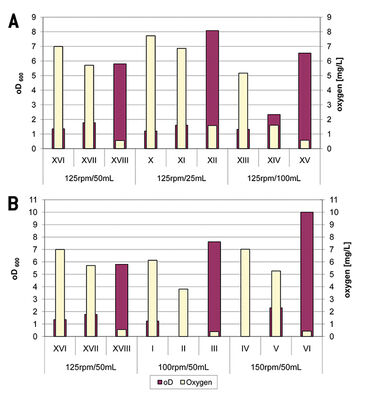
Für die Experimente wurden 300 ml-Schüttelkolben mit Schikanen verwendet. Bei einigen davon wurde ein O2 Sensor Spot (PreSens) innen an der Bodenfläche angebracht. Der Coaster CFG, ein Adapter, wurde unter der Schüttelflasche direkt gegenüber dem Sensor platziert und mit dem Sauerstoffmessgerät Fibox 3 von PreSens verbunden, um die Sensorantwort auszulesen. Die Sauerstoffkonzentration wurde während der gesamten Kultivierung mit einer Abtastrate von 30 Sekunden überwacht und aufgezeichnet. Ein Wildtyp-Stamm von C. glutamicum ATCC13032 und zwei Wildtyp-Stämme von C. diphtheriae - DSM44123 und DSM43988 - wurden für diese Studie verwendet [1]. Um Unterschiede im Sauerstoffmangel bei verschiedenen Kulturbedingungen zu untersuchen, wurden Volumina von 25 ml, 50 ml und 100 ml bei einer Schüttelgeschwindigkeit von 125 U / min und zwei zusätzliche Kulturen von 50 ml Volumen bei Schüttelgeschwindigkeiten von 100 U / min und 150 U / min getestet. Für jede Testreihe wurden vier parallele Kulturen in den Schüttelkolben inokuliert. In jeder Serie wurden drei Proben von 15 ml entnommen, jede aus einem anderen Schüttelkolben, um Aktivitätsmessung der Glutamat-Dehydrogenase und zur RNA-Hybridisierung durchzuführen: nach 0,5 Stunden, 2,5 Stunden und 6,5 Stunden. Der verbleibende Schüttelkolben war mit dem Sensorspot zur Sauerstoffüberwachung ausgestattet. Das gdh-DNA-Fragment wurde durch Kolonie-PCR amplifiziert und anschließend gelelektrophoretisch gereinigt und mit NucleoSpin® Extract Kit (Macherey-Nagel, Düren) extrahiert. Die GDH-Aktivität wurde wie von T. Müller [2] beschrieben gemessen und mit der folgenden Gleichung berechnet:
Aktivität = (ΔA • V) / (ε • t • m • d)
Delta A ist die Abnahme der Absorption und V das Gesamtreaktionsvolumen. Epsilon ist der Extinktionskoeffizient, t die Reaktionszeit, m Protein im Reaktionsgemisch (in mg) und d die Schichtdicke. Das Protein in der Reaktionsmischung wurde mit Roti-Quant® bei OD595 gemessen. Die Isolierung der Gesamt-RNA wurde mit dem NucleoSpin® RNA II-Kit (Macherey-Nagel, Düren) durchgeführt. Die Synthese von Digoxigenin-markierten RNA-Sonden und RNA-Hybridisierung erfolgte wie von E. Hänssler beschrieben [3].
Sauerstoffmangel & Wachstumsrate
Die Sauerstoffkonzentrationen nach 0,5, 2,5 und 6,5 Stunden Kultivierung wurden mit der optischen Dichte zu diesen Zeitpunkten verglichen (Fig. 1). Es konnte beobachtet werden, dass die Wachstumsrate sowohl von C. glutamicum als auch von C. diphtheriae von der Sauerstoffversorgung abhängig ist. Unterschiedliche Bedingungen, wie unterschiedliche Schüttelgeschwindigkeiten und Kulturvolumina, führten zu Schwankungen in der Sauerstoffversorgung. In der Summe erhöhte sich die Wachstumsrate, je mehr Sauerstoff verfügbar war, was mit bereits bekannten Daten übereinstimmt. Bei der Kultivierung schnell wachsender Bakterien wie C. glutamicum ist es sehr wichtig, die Wachstumsrate und Sauerstoffkonzentration in Korrelation zu beobachten. Zum Beispiel zeigten Kulturen von C. glutamicum, die mit 150 U / min geschüttelt wurden, einen niedrigeren Sauerstoffgehalt, aber eine höhere OD als Kulturen, die mit 125 U / min geschüttelt wurden, was im Laufe der Zeit einen Sauerstoffmangel verursachen hätte können. Der Sauerstoffverbrauch langsam wachsender Bakterien wie C. diphtheriae ist sehr gering, so dass er durch Sauerstoffeintrag nahezu ausgeglichen wird. In allen Versuchsreihen überstieg der Sauerstoffverbrauch den Sauerstoffeintrag und die O2-Konzentration nahm ab. Keine Versuchsreihe erreichte eine vollständige Sauerstofflimitierung.
Auswirkungen von Sauerstoffmangel auf GDH
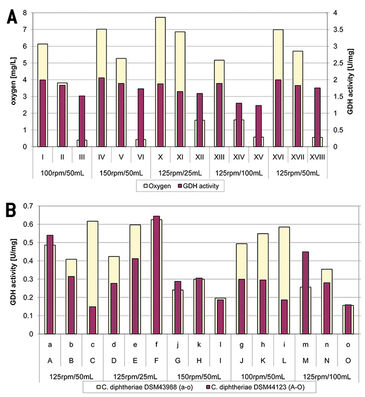
Ein Vergleich von GDH-Aktivität und Sauerstoffmangel für C. glutamicum ergab keine enge Korrelation (Abb. 2A); eine Abnahme des Sauerstoffs führte sowohl zu einer starken als auch zu einer schwachen Abnahme der GDH-Aktivität. Darüber hinaus konnte keine signifikante Korrelation zwischen einer Abnahme von Sauerstoff und der Menge an gdh-Transkript beobachtet werden. Die Abnahme der GDH-Aktivität lag in einem Bereich von 0,25 bis 0,7 U / mg über 6,5 Stunden. Diese Werte sind sehr niedrig und könnten durch eine Fluktuation oder durch andere regulierende Prozesse verursacht worden sein. Nichtsdestotrotz kann ein Einfluss von Sauerstoffmangel auf die GDH-Aktivität nicht ausgeschlossen werden. Im Gegensatz zu C. glutamicum konnte in beiden C. diphtheriae-Stämmen ein leichter Anstieg der GDH-Aktivität unter bestimmten Kulturbedingungen beobachtet werden (Abb. 2B). Aber die gemessenen Werte waren sehr niedrig und möglicherweise nicht signifikant. Die Sauerstoffkonzentration nahm während der Kultivierung in beiden Stämmen von C. diphtheriae mehr oder weniger ab, während die GDH-Aktivität sowohl zunahm als auch abnahm. Der Dot-Blot für C. diphtheriae DSM44123 zeigte einen Anstieg im Transkript (außer: 25 ml / 125 UpM), der nicht mit der Messung der GDH-Aktivität korreliert. Dies könnte darauf hinweisen, dass Glutamat-Dehydrogenase posttranskriptional reguliert wird. Die Dot-Blot Analyse und GDH - Aktivitätsmessung im Stamm C. diphtheriae DSM43988 stimmten mehr oder weniger überein, korrelieren jedoch nicht mit den Ergebnissen von C. diphtheriae DSM 44123. Da sich die Ergebnisse der beiden Stämme unterscheiden, kann keine klare Aussage über den Einfluss von Sauerstoffmangel auf GDH in C. diphtheriae getroffen werden.
Zusammenfassung & Perspektiven
In Kulturen von C. glutamicum und C. diphtheriae konnte unter den getesteten Inkubationsbedingungen kein eindeutiger Einfluss der Sauerstoffkonzentration auf die GDH-Aktivität beobachtet werden. Da nur sehr niedrige GDH-Aktivitätswerte gemessen werden konnten, müssten weitere Tests mit größeren Proteinmengen durchgeführt werden. Die Ergebnisse für C. glutamicum-Kultur bestätigten nicht den erwarteten Einfluss, der in der Studie von T. Müller beobachtet wurde [2]. Andere Bedingungen, wie etwa Kultivierung bei noch niedrigeren Schüttelraten oder ganz ohne Schütteln, müssten noch getestet werden. Da erwartet wird, dass ein Sauerstoffmangel die GDH-Aktivität reduziert, könnte der umgekehrte Ansatz - zusätzlicher Sauerstoffeintrag - detailliertere Einblicke ermöglichen. Diese neuen Ansätze könnten bessere oder signifikantere Ergebnisse für die GDH-Aktivitätsmessung liefern.
Applikationsbericht nach:
[1] Böhme, M. (2008), Oxygen depletion in cultures of Corynebacterium glutamicum and Corynebacterium diphtheriae and its effect on glutamate dehydrogenase, Bachelor thesis, FAU Erlangen-Nürnberg, Deutschland
Referenzes:
[2] Müller, T. (2005), Regulation of glutamate dehydrogenase in Corynebacterium glutamicum and its impact on nitrogen control, Doktorarbeit, Universität zu Köln, Deutschland
[3] Hänssler, E. (2008), Regulation of glutamate dehydrogenase in Corynebacterium glutamicum, Doktorarbeit, FAU Erlangen-Nürnberg, Deutschland