Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Energiekatabolismus-Messungen in metastatischen Makrophagen-M3-Zellen
Messung der Zellatmung mit dem SDR SensorDish® Reader und dem KF 96 Extracellular Flux Analyzer
Robert Flores1, Brian Coy2, Karen Studer-Rabeler2, und Thomas N. Seyfried1
1Biology Department, Boston College, Chestnut Hill, MA, USA
2Coy Laboratory Products, Inc., Grass Lake, MI, USA
Um die Rolle einer Mykoplasma-Infektion auf den Katabolismus von Krebszellen zu untersuchen, haben wir den Sauerstoffverbrauch und die Laktatproduktion in infizierten oder nicht-infizierten metastatischen Makrophagen-M3-Zellen gemessen. Wir haben zwei verschiedene Sauerstoffmesssysteme, den SDR SensorDish® Reader von PreSens und den XF 96 Analyzer von Seahorse Bioscience, eingesetzt, um die Zellatmung zu untersuchen. Diese Systeme basieren auf unterschiedlichen Sauerstoffmessprinzipien, lieferten jedoch ähnliche Ergebnisse, die darauf hinweisen, dass eine Mykoplasma-Infektion einen Einfluss auf den Gesamtzellkatabolismus haben kann. Die Analyse der Lactatproduktion in infizierten und nicht-infizierten M3-Zellen bestätigt die Ergebnisse der Sauerstoffmessung.
Der Energiekatabolismus in Säugetierzellen besteht hauptsächlich aus Atmung (oxidative Phosphorylierung) und Lactatfermentation. Typischerweise wird die Atmung über den O2-Verbrauch und die Fermentation über die Lactatproduktion gemessen. Normale Säugerzellen beziehen den Großteil ihrer Energie durch Atmung (die Fermentation liefert selten einen wesentlichen Teil der benötigten Energie, es sei denn, O2 ist nicht verfügbar oder pathologische Prozesse sind involviert). Wenn die Energie, die durch die Atmung gewonnen wird, durch Hypoxie und / oder Pathologie begrenzt ist, wird die Fermentation bei dem Versuch zu Kompensieren zunehmen. Daher ist es wichtig, den O2-Verbrauch und die Laktatproduktion bei der Untersuchung von Stoffwechselerkrankungen messen zu können. Mycoplasmen der Mollicutes-Klasse gelten als die kleinsten selbstreplizierenden freilebenden Prokaryoten [1]. Zusätzlich zu der engen Verbindung von Mykoplasma-Infektion mit den Merkmalen und Charakteristiken von Krebs [2, 3, 4, 5], bestärkt ihre Anwesenheit in einer Vielzahl von humanen Primärtumorproben [6, 7, 8] die Möglichkeit, dass sie eine ursächlichen oder zumindest modulatorische Rolle bei der Humankarzinogenese [9] spielt. Eine Verbindung zwischen Krebszellenkatabolismus und infizierten Zellen würde diese Hypothese bestätigen. Daher analysierten wir den Energiekatabolismus von metastatischen Makrophagen-M3-Zellen, die entweder mit M. arginini infiziert oder nicht infiziert waren. Wir verwendeten zwei Methoden zur Messung des O2-Verbrauchs, den SDR SensorDish® Reader (PreSens; Abb. 1A) und den XF 96 Extracellular Flux Analyzer (Seahorse Bioscience). Mit dem XF 96 Analyzer können quantitative Atmungsmessungen auf Basis des O2-Verbrauchs in kleinen Volumina durchgeführt werden. Es verfügt über interne Heizelemente für Temperaturstabilität, Injektionsöffnungen für Medikamente zur Überwachung der unmittelbaren Auswirkungen und ist in der Lage, Analysen mit hohem Durchsatz durchzuführen. Das SDR-System kann für kontinuierliche Langzeitmessungen verwendet werden. Mit diesem Lesegerät können gelöster Sauerstoff und pH leichter bei einer voreingestellten Sauerstoffspannung überwacht werden, und es verursacht geringere Kosten in der Anschaffung und für Verbrauchsmaterialien. Darüber hinaus können Zellen in Suspension - einschließlich Bakterien - mit dem SDR überwacht werden. Obwohl beide Systeme den pH-Wert auch als indirekten Indikator für die Lactatfermentation messen können, wurden in dieser Studie stattdessen direkte enzymatische Lactatmessungen gemacht.
Material & Methoden
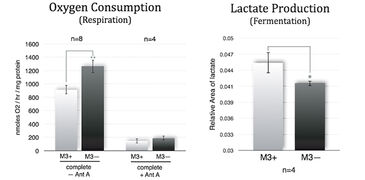
Der SDR SensorDish® Reader (PreSens) ist ein Mehrkanal-System, das paralleles Auslesen von Sauerstoffsensoren ermöglicht, die in jedem Well von 6- oder 24-Well-Multidishes, sogenannten OxoDishes® (PreSens), integriert sind. Der Reader ist an einen PC / Notebook angeschlossen und das Messintervall wird mit der SDR-Software eingestellt. Der XF 96 Analyzer (Seahorse Bioscience) isoliert ein kleines Volumen (<7 μl) von Medium oberhalb der Zellen in einer speziellen 96-Well-Mikroplatte (XF 96 Microplate, Seahorse Bioscience). Der zelluläre O2-Verbrauch verursacht Änderungen des gelösten O2-Niveaus in dieser vorübergehenden Mikrokammer, die alle paar Sekunden durch stationäre Sensorsonden gemessen wird, die sich 200 μm über den Zellen befinden. Für Messungen des Energiekatabolismus mit dem SDR (Abb. 1B) wurde DMEM mit hohem Glucoseanteil und 10 % FBS verwendet. M. arginini wurden alleine kultiviert, um ihren O2-Verbrauch relativ zu dem von infizierten M3-Zellen zu bewerten. Wir verwendeten SP-4-Medienergänzung mit 4 mM Arginin, um den M. arginini O2-Verbrauch zu messen. Für die Massenspektrometrieanalyse und O2-Messung mit dem XF 96 Analyzer verwendeten wir vollständige Medien (DMEM-Base + 10 mM Glucose + 2 mM Glutamin + Alubmax I).
Energiekatabolismus von M3 Zellen
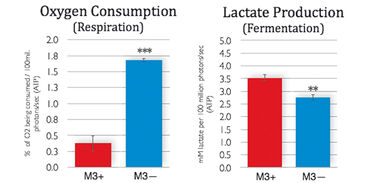
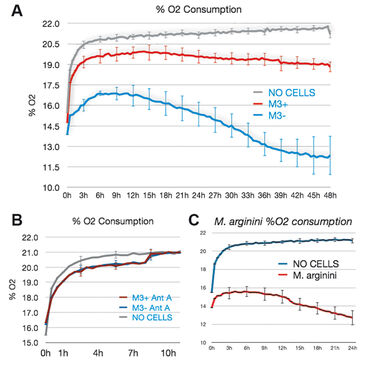
M3-Zellen, die mit M. arginini (M3+ Zellen) infiziert waren, wurden mit Antibiotika behandelt, um die Infektion zu beseitigen (M3- Zellen). Langzeitmessungen mit dem SDR über einen Zeitraum von 48 Stunden zeigten, dass nicht-infizierte M3- Zellen während der gesamten Kultivierungszeit mehr Sauerstoff verbrauchten als infizierte M3+ Zellen. M3- Zellen hatten eine erhöhte Atmung und verminderte Fermentationsaktivität (Abb. 3). Dies deutet darauf hin, dass die Bakterien einen Einfluss auf den gesamten zellulären Katabolismus hatten. Wie erwartet, reagierte die M3+ und M3- Zellatmung weitgehend empfindlich auf Antimycin A (einem Atmungsketteninhibitor), wie in 2B zu sehen ist. M. arginini, allein kultiviert, verbrauchte ebenso O2 (Abb. 2C), was zusammen mit dem O2-Verbrauch durch Atmung der infizierten Zellen betrachtet werden muss. Die mit dem XF 96 Analyzer vorgenommenen Messungen der O2-Verbrauchsrate von M3+ und M3- Zellen (Abb. 4) bestätigten die SDR-Ergebnisse, obwohl über einen viel kürzeren Zeitraum (2 h vs. 2 Tage) überwacht wurde. Wiederum erhöhten M3- Zellen ihre Atmung und verringerten die Fermentation, und sowohl die M3+ als auch die M3- Zellatmung waren gegenüber Antimycin A empfindlich. Die Lactatproduktion wurde sowohl durch enzymatischen Assay korrigiert auf ATP-Niveau (Abb. 3) gemessen, als auch durch Kapillarelektrophorese-Massenspektrometrie bestimmt und auf Zellzahl (Fig. 4) korrigiert. Die Ergebnisse stimmen mit den Sauerstoffmessdaten überein.
Zusammenfassung
Im Vergleich zu metastatischen Makrophagenzellen, die mit M. arginini infiziert sind, zeigen nicht-infizierte Zellen eine erhöhte Atmung und verminderte Fermentationsaktivität, was darauf hindeutet, dass die Bakterien eine Auswirkung auf den gesamten zellulären Katabolismus haben könnten. Während beide in dieser Studie verwendeten Messgeräte unterschiedliche Messprinzipien verwenden, erzielten wir ähnliche Ergebnisse mit dem SDR und dem XF 96 Analyzer bei der Messung des O2-Verbrauchs von infizierten und nicht-infizierten Zellen. Insgesamt hat jedes der beiden Systeme seine Vorteile, und beide lieferten präzise und kontinuierliche Sauerstoffmessungen, die zu unseren Forschungsergebnissen beitragen.
Referenzen
[1] G. Rawadi, et al. (1995), PCR Methods Appl. 4, 199 - 208
[2] D. Hanahan, et al. (2001), Cell 144, 646 - 674
[3] G. Paton, et al. (1965), Nature 207, 43 - 45
[4] D. Y. Logunov, et al. (2008), Oncogene 27, 4521 - 4531
[5] S. Zhang, et al. (2004), Blood 104, 4252 - 4259
[6] S. Huang, et al. (2001), World J. Gastroenterol. 7, 266 - 269
[7] M. Pehlivan, et al. (2005), Urology 65, 411 - 414
[8] M. Kidder, et al. (1998), Gynecol. Oncol. 71, 254 - 257
[9] M. B. Rogers (2011), Oncotarget