Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Hochdurchsatz-Respirations-Assay zur Zytotoxizitätsbestimmung
Eine Methode zur Bewertung neuer pharmazeutischer Wirkstoffe mit dem SDR SensorDish® Reader
Marie-Theres Weil, und Tobias Werner
Institut für Analytische Chemie, Hochschule Mannheim, Deutschland
Das Ziel dieses Projektes war die Entwicklung eines Zytotoxizitäts-Assays mit hohem Durchsatz mittels Überwachung der Zellatmung in Zellkulturen. Die Zellen wurden in 24 Well Platten mit integrierten chemisch-optischen Sensoren (OxoDishes®) kultiviert, die online und nicht-invasiv mit dem SDR SensorDish® Reader ausgelesen wurden. Damit konnte die Wirkung verschiedener Konzentrationen von zytotoxischen und zytostatischen Substanzen auf die Zellatmung leicht bestimmt werden. Die Ergebnisse zeigten, dass eine eindeutige Unterscheidung zwischen zytotoxischen und zytostatischen Verbindungen durch Online-Überwachung der Zellatmung erfolgen kann.
Mit einer zunehmenden Anzahl neuer Wirkstoffe wird es immer wichtiger, effiziente und schnelle Screening-Ansätze für die industrielle Anwendung zu finden. In dieser Studie wurde ein Hochdurchsatz-Zytotoxizitäts-Assay durch Überwachung der Zellatmung in Zellkultur entwickelt. Wenn Zellen mit zytotoxischen Verbindungen behandelt werden, tendieren sie dazu apoptotisch zu werden und verbrauchen keinen Sauerstoff mehr. Wenn die Menge an Sauerstoffdiffusion in das Medium größer ist als der Sauerstoffverbrauch der verbleibenden überlebenden Zellen, steigt der Gesamtgehalt an gelöstem Sauerstoff im Medium an. Im Gegensatz dazu sollte der Sauerstoffverbrauch bei der Behandlung von Zellen mit zytostatischen Verbindungen als Folge des gestoppten Proliferationsprozesses relativ konstant bleiben. Chinesische Hamster Ovarialzellen wurden in OxoDishes® von PreSens kultiviert. Die optischen Sauerstoffsensoren am Boden jedes Wells wurden online und nicht-invasiv mit dem SDR SensorDish® Reader ausgelesen, mit dem die Sauerstoffaufnahme in allen 24 Wells einer Platte gleichzeitig überwacht werden konnte. Neben anderen - hier nicht gezeigten - Tests wurde die Wirkung verschiedener Konzentrationen von zytotoxischen und zytostatischen Substanzen auf die Zellatmung mit diesem System bestimmt.
Material & Methoden
Die Zellen wurden in 24 Well OxoDishes ® kultiviert. Die chemisch-optischen Sensoren am Boden jeder Vertiefung wurden mit dem PreSens SDR ausgelesen. Der SDR kann im Inkubator platziert werden und ermöglicht die Online-Überwachung von Sauerstoff in den Kulturen während der gesamten Behandlungsdauer. Für Zellatmungsexperimente wurde die chinesische Hamster Ovarialzelllinie CHO-K1 verwendet. Diese Zellen wurden in Ham’s F-12-Medium, ergänzt mit 10 % FCS und 1 % Penicillin-Streptomycin, gehalten und bei 37 °C in einer 5 % CO2-Atmosphäre inkubiert. Die optimale Zelldichte betrug 300.000 Zellen pro Well. Diese optimale Dichte muss für jede Zellcharge bestimmt werden, da sich das Zellwachstum mit der Anzahl der Zellpassagen ändert. Die Zellen wurden 24 Stunden lang in 1 ml Medium gezüchtet. 1 ml frisches Medium wurde zugegeben, das die zytotoxischen oder zytostatischen Substanzen in verschiedenen Konzentrationen enthielt. Der Gehalt an gelöstem Sauerstoff wurde alle 10 Minuten für 24 Stunden gemessen. Nach den Respirationsmessungen wurde die Lebensfähigkeit der Zellen direkt unter Verwendung des Standard-MTT-Tests bewertet. Alle Stammlösungen der Testverbindungen wurden in Ham's F-12-Medium gelöst, falls erforderlich, wurde 1 % Endkonzentration von DMSO verwendet und dann in geeigneter Weise mit Medium verdünnt, um die gewünschten Konzentrationen zu erhalten. Um die mittlere letale Konzentration LC50 einer zytotoxischen Verbindung zu bestimmen, wurde der Gehalt an gelöstem Sauerstoff nach 24 Stunden Behandlung über die entsprechende Verbindungskonzentration in einem Graphen aufgetragen. Die resultierende Kurve wurde auf eine vierparametrige, sigmoidale Konzentrations-Antwort-Kurve in OriginPro Version 8.0 angepasst.
Wirkung von zytotoxischen Verbindungen auf die Zellatmung
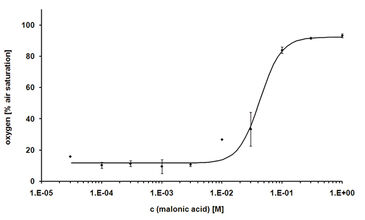
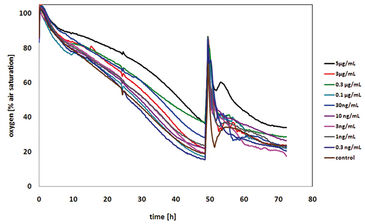
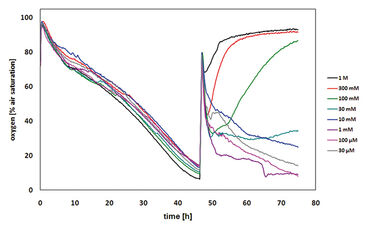
Die ersten Zytotoxizitätstests wurden mit Malonsäure durchgeführt. Subletale Konzentrationen von Malonsäure hatten keinen Einfluss auf den Sauerstoffverbrauch der CHO-K1 Zellen, was zu einem verringerten Gehalt an gelöstem Sauerstoff im Medium führte. Als Folge hoher Malonsäurekonzentrationen wurde der Zelltod induziert und somit kein Sauerstoff mehr verbraucht. Aufgrund der Sauerstoffdiffusion aus der Umgebungsluft stieg der gelöste Sauerstoff bis zu 100 % Luftsättigung an (Abb. 2). Der gelöste Sauerstoffgehalt nach 24 Stunden Behandlung wurde über der entsprechenden Konzentration von Malonsäure aufgetragen, um die LC50 zu bestimmen, die 34 mM betrug (Abb. 3). Dieser Wert stimmt sehr gut mit dem LC50-Wert überein, der durch den MTT-Test (31 mM) bestimmt wurde. Der Literaturwert (4 mM) war etwas niedriger, was auf die Verwendung einer anderen Zellinie zurückzuführen ist. Weitere Tests mit anderen zytotoxischen Verbindungen wurden durchgeführt (Ergebnisse nicht gezeigt, siehe [1]).
Wirkung von zytostatischen Verbindungen auf die Zellatmung
Derselbe experimentelle Aufbau wurde für die Assays mit Colcemid (Demecolcin) verwendet. Colcemid kann Mikrotubuli depolymerisieren, indem es die Bildung von Mikrotubuli durch Hemmung der Spindelfaserbildung begrenzt und so Zellen in der Metaphase hält. Die Ergebnisse, die wir aus diesen Assays erhielten, bewiesen, dass mit Colcemid behandelte Zellen nicht absterben. Der Sauerstoffgehalt im Medium war relativ konstant, was auf eine konstante Zellatmung hindeutet. Der Gehalt an gelöstem Sauerstoff vor und nach der Behandlung war ungefähr derselbe. Somit verbrauchten die Zellen konstant die gleiche Menge an Sauerstoff pro Zeiteinheit, da der Zellzyklus inhibiert und keine Zellteilung möglich war (4). Darüber hinaus konnte ein nicht signifikanter Unterschied im Sauerstoffverbrauch nach 24 Stunden Behandlung mit verschiedenen Colcemid-Konzentrationen festgestellt werden. Die Unterschiede an gelöstem Sauerstoffgehalt im Medium lassen sich durch die leicht unterschiedlichen Zellzahlen in den aufeinanderfolgenden Wells erklären. Somit konnte gezeigt werden, dass Colcemid für CHO-K1 Zellen nicht toxisch ist, sondern eher ein Zytostatikum. Dieses Ergebnis wurde durch den MTT-Test unterstützt, der die Lebensfähigkeit der Zellen nach 24 Stunden Behandlung bestätigte. Keine der Proben wurde als nicht-lebensfähig eingestuft, und die unterschiedlichen Absorptionswerte können durch unterschiedliche Zellzahlen erklärt werden.
Zusammenfassung
Die Ergebnisse zeigen, dass eine eindeutige Unterscheidung zwischen zytotoxischen und zytostatischen Verbindungen durch Online-Überwachung der Zellatmung erfolgen kann. Die mit dem SDR erhaltenen Ergebnisse korrelieren mit dem MTT-Assay und sind daher ein guter Indikator für die Zytotoxizität. Literaturwerte für Zytotoxizitätsverbindungen sind etwa 10-mal niedriger als die in unseren Experimenten bestimmten LC50. Aufgrund der großen Unterschiede zwischen Zelllinien und Primärzellen können nur allgemeine Vergleiche gezogen werden. Zusammenfassend haben die Experimente gezeigt, dass das SDR-Messsystem eine schnelle und einfach zu bedienende Online-Methode zur Bestimmung der Zytotoxizität neuer pharmazeutischer Verbindungen bietet.
Applikationsbericht nach
[1] M.-T. Weil and T. Werner, Cytotoxicity Determination: A method for the evaluation of new active pharmaceutical ingredients, GIT Laboratory Journal 2012 5 - 6