Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Imaging von pH- und CO2-Dynamiken in der Rhizosphäre
Pflanzenwurzel-Boden-Interaktionen quantifiziert mit dem VisiSens™ System
S. Blossfeld1, C. M. Schreiber2, G. Liebsch3, A. J. Kuhn1, und P. Hinsinger2
1Forschungszentrum Jülich GmbH, Institut für Bio- und Geowissenschaften, IBG-2: Pflanzenwissenschaften, Jülich, Deutschland
2INRA, UMR Eco&Sol, Montpellier, Frankreich
3PreSens Precision Sensing GmbH, Regensburg, Deutschland
Prototyp VisiSens™ Geräte für die pH- und CO2-Bildgebung wurden verwendet, um kontinuierliche und hochaufgelöste Messungen in Rhizobox-Systemen durchzuführen. Der pH-Wert wurde an Hartweizenwurzeln gemessen, die mit Kichererbsenwurzeln durchsetzt waren, während die CO2-Dynamik in der Rhizosphäre von Viminaria juncea aufgezeichnet wurde. Die zweidimensionalen Analytkarten zeigten, dass Weizenwurzelspitzen leicht ansäuerten, während die Wurzelhaarzone die Rhizosphäre basisch machte. Kichererbsenwurzeln säuerten die Umgebung stark an, außer in Regionen, in denen sie mit Weizenwurzeln kreuzten, welche alkalischer blieben. CO2-Messungen zeigten, dass die wachsende Wurzel von Vininaria juncea Einfluss auf den CO2-Gehalt des Bodens in ihrer Umgebung hatte. Nicht-invasive Bildgebung mit planaren Optroden ist eine ideale Methode in der heterogenen Umgebung von Wurzelforschungsanwendungen.

Die Region des Bodens, die direkt von Wurzeln und assoziierten Mikroorganismen beeinflusst wird, heißt Rhizosphäre. Die Untersuchung biochemischer Prozesse in dieser sehr heterogenen und nichtsterilen Umgebung ist sehr schwierig und oft durch die zur Verfügung stehende Überwachungstechnologie sehr eingeschränkt. In dieser Studie wurden chemische optische Sensorfolien verwendet, um die pH- und CO2-Dynamiken in der Umgebung wachsender Wurzeln verschiedener Pflanzenarten aufzuzeichnen. Die Prototyp pH- und CO2-Bildgebungsgeräten (VisiSens™ A2 und A3, PreSens) erlauben eine nicht-invasive Messung dieser Schlüsselparameter in der Rhizosphäre, so dass naturnahe Anordnungen untersucht werden konnten. Dazu wurden chemisch-optische Sensorfolien in Rhizoboxen angebracht und 2-dimensionale Analytkarten mit den VisiSens™ Fluoreszenzmikroskopen aufgenommen.
Material & Methoden
Hartweizen (Triticum turgidum durum 'LA 1823') und Kichererbse (Cicer arietium 'ILC 01302', nicht mit Mesorhizobium ciceri geimpft) wurden unter Gewächshausbedingungen (25 ± 2 °C, 8 / 16 h Dunkel / Hell-Zyklen, 50 - 55 % relative Luftfeuchtigkeit) herangezogen. Zwei Wochen nach der Keimung wurden beide Arten zusammen in eine Rhizobox (40 x 20 x 2 cm) gepflanzt, um die Wurzelwechselwirkungen zwischen den Arten zu untersuchen. Die Rhizobox wurde in einer Klimakammer (20 °C, 10 / 14 h Dunkel / Hell-Zyklus, 200 μmol Photonen m-2 s-1, 60 % rel. Feuchte) aufbewahrt. Die Box hatte eine einzige Frontplatte, die zur Montage der Sensorfolien entfernt werden musste (Abb. 1 A). Während des Wurzelwachstums wurden interessante Untersuchungsbereiche in den Wurzelsystemen ausgewählt, d. h. wo Wurzeln beider Arten sich kreuzten, um die räumliche und zeitliche Dynamik von pH-Änderungen zu überwachen. Nach der Installation der Sensorfolie wurden die Rhizoboxen um 30 ° aus der Vertikalen gekippt, um das Wurzelwachstum direkt hinter der Sensorfolie zu erzwingen. Wir befestigten die Kamera 60 mm von den Sensorfolien entfernt, um die pH-Dynamik über die nächsten Tage in 10 min-Intervallen zu überwachen. Viminaria juncea wurde in einer Klimakammer (20 °C, 10 / 14 h Dunkel / Hell-Zyklus, 200 μmol Photonen m-2 s -1, 60 % rel. Feuchte) gezogen. Für die Experimente wurde sie in eine wassergesättigte, mit Sand gefüllten Rhizobox (40 x 20 x 2 cm) gepflanzt. Die Bodentemperatur wurde konstant bei 20 °C gehalten, um während der gesamten Experimente gleiche Respirationsraten von Wurzeln und Mikroorganismen aufrechtzuerhalten. Die Rhizobox musste geöffnet werden, um die CO2-Sensorfolien an der Frontplatte der Box zu befestigen (Abb. 1 B). Nach dem Schließen wurde die Rhizobox um 30 ° aus der Vertikalen gekippt. Danach wurde die Rhizobox erneut mit Nährmedium durchfeuchtet. Nach 1 d Äquilibrierung wurde die VisiSens™ A3 Detektoreinheit auf der Frontplatte gegenüber der Sensorfolie befestigt und der CO2-Gehalt der Fläche über die nächsten 3 Tage in 10 min-Intervallen gemessen.
pH in der Umgebung von Weizen- und Kichererbsenwurzeln in Zwischenfruchtanbau
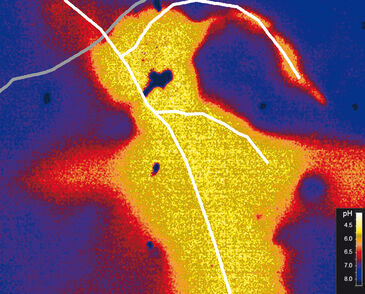
Wir beobachteten die pH-Dynamik in einer Rhizobox, in der beide Arten - Hartweizen und Kichererbse – zusammen wuchsen, über 10 Tage mit dem Prototyp VisiSens™ A2. Die Karten zeigten pH-Änderungen um sich entwickelnde seitliche Wurzeln der Kichererbse und einer wachsenden Weizenwurzel. Die Spitze der wachsenden Weizenwurzel zeigte entlang der Elongationszone einen angesäuerten Bereich (von pH 8 bis pH 7). Diese Ansäuerung hörte auf, als die Elongationsszone vorbeizog und Wurzelhaare gebildet wurden (Abb. 2, oben links). Der Boden wurde wahrscheinlich aufgrund der großen Nitrataufnahme der Wurzeln alkalisiert. Die überschüssige Anionenaufnahme wurde durch Protoneneinstrom kompensiert. Mit den chemisch-optischen Sensoren konnte selbst die leichte Ansäuerung an wachsenden Wurzelspitzen nachgewiesen werden, was mit anderen Messmethoden möglicherweise nicht bemerkt worden wäre. Hier fand eine stärkere Aufnahme von Anionen als von Kationen statt, was mit dem in der Literatur beschriebenen Säuremechanismus übereinstimmt. In der Mitte unserer Aufnahmen wuchs eine Kichererbsenwurzel von oben nach unten und entwickelte während des untersuchten Zeitraums zwei seitliche Wurzeln. Die Hauptwurzel und die basalen Teile der Seitenwurzeln säuerten ihre Rhizosphäre stark an - auf pH 6 oder tiefer (Abb. 2). Nur in dem Bereich, in dem die Weizenwurzel die Kichererbsenwurzel kreuzte, blieb die Rhizosphäre in der oberen linken Ecke alkalischer. Die Spitze der oberen lateralen Kichererbsenwurzel zeigte eine klar lokalisierte Ansäuerungszone, die sich über die Zeit mit dem Wurzelwachstum durch das Substrat bewegte.
CO2 in der Umgebung von Viminaria juncea Wurzeln
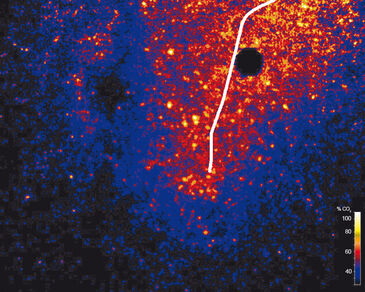
Eine wachsende Wurzelspitze von V. juncea zeigte während eines dreitägigen Monitorings mit dem Prototyp VisiSens™ A3 erhöhte pCO2-Spiegel (Abb. 3). pCO2 veränderte sich zusammen mit der wachsenden Wurzel und erreichte Werte von bis zu 70 % CO2. Dieser starke Einfluss auf den pCO2-Gehalt des Bodens wurde in einem Bereich von mehreren Millimetern um die wachsende Wurzel herum nachgewiesen. Die Veränderungen in pCO2 wurden wahrscheinlich nicht nur durch autotrophe Atmungsaktivität sondern auch durch heterotrophe Aktivität eines Biofilms auf der Wurzeloberfläche verursacht. Die wassergesättigten Bedingungen bewirkten - aufgrund der verringerten Diffusion von CO2 in Wasser - einen Anstieg des CO2. Die Sensorfolien erwiesen sich als geeignetes Werkzeug zur Messung von CO2 und der räumlichen Verteilung von Hotspots biologischer Aktivität im Boden.
Zusammenfassung
Mit den neuen Prototypsystemen konnten wir pH-Änderungen in sehr heterogenen und dynamischen Mikroumgebungen überwachen und sogar gegensätzliches Verhalten für Wurzeln verschiedener Pflanzenarten nachweisen. Die CO2-Sensorfolien gaben uns die Möglichkeit, völlig neue Erkenntnisse zu gewinnen. Die Generierung quantitativer Karten von Schlüsselparametern der Rhizosphäre mit hoher räumlicher Auflösung ist ein großer Vorteil. Die VisiSens™ Systeme erwiesen sich bei der Untersuchung von Wurzel-Boden-Interaktionen als großer Fortschritt. Da die Systeme relativ einfach zu handhaben sind und bald die Möglichkeit besteht, noch mehr Analyten zu messen, könnten sich diese Geräte in der Wurzelforschung etablieren.
Applikationsbericht nach
Blossfeld, et al.: Quantitative imaging of rhizosphere pH and CO2 dynamics with planar optodes, Annals of Botany (2013) 112 (2), 267 - 276