Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Immobilisierte Pflanzenzellen - Von der DSMZ zum Kunden
Nachweis metabolischer Aktivitäten von immobilisierten Pflanzenzellen während des simulierten Zelltransports in einem geschlossenen System mit Hilfe der VisiSens-Technologie
Nicole Brinkmann, Martina Westphal, Elke Heine-Dobbernack, und Martin Schumacher
Leibniz Institut DSMZ - Deutsche Sammlung von Mikroorganismen und Zellkulturen, Braunschweig, Deutschland
Die DSMZ ist eines der größten biologischen Ressourcenzentren weltweit. Ihre Sammlungen umfassen derzeit fast 40.000 Artikel, darunter etwa 700 undifferenzierte Pflanzenzelllinien. Der Einsatz von Pflanzenzelllinien für die Grundlagen- und angewandte Forschung ist auf stabiles Material angewiesen. Für pflanzliche Zelllinien ist die zuverlässige Langzeitkonservierung und -verteilung ein wesentlicher Schwerpunkt und immer noch keine Routine. Die Forschungsaktivitäten zielen daher darauf ab, neue und fortschrittliche Methoden für die Kryokonservierung von Pflanzenzellen zu entwickeln, aber auch den Transport zu den Kunden zu verbessern. Das VisiSens™ CO2-Bildgebungssystem wurde verwendet, um die Stoffwechselaktivität und damit die Fitness lebender Zellen in luftdichten Transportsystemen zu überwachen. Die CO2-Überwachung zusammen mit der pH- und O2-Bildgebung in den versiegelten Ampullen zeigte, dass immobilisierte Pflanzenzellen sogar nach 10 Tagen Lagerung in den Transportgefäßen metablatische Aktivität aufweisen.
Im Gegensatz zu Bakterienzellen sind Pflanzenzelllinien aufgrund ihres hohen Wassergehaltes und ihrer subzellulärer Struktur schwierig zu kryokonservieren. Es gibt immer noch keine routinemäßige Langzeitkonservierungsmethode, ein regelmäßiger routinemäßiger Kulturtransfer verursacht eine konstante Arbeitslast, und die kontinuierliche Subkultivierung birgt das Risiko, Kulturen durch Laborversagen oder durch genetische / epigenetische Veränderungen zu verlieren. Unsere Forschung konzentriert sich daher auf die Etablierung geeigneter Gefrier- und Verteilungsmethoden für Pflanzenzelllinien. Ein Ansatz für die Kryokonservierung verwendet die Verkapselung von Pflanzenzellen in Alginatkügelchen, die dann kryokonserviert und in flüssigem Stickstoff gelagert werden, bis sie ein Kunde anfordert. Da Pflanzenzellen den Transport bei - 70 °C oft nicht überleben und der Transport bei Flüssigstickstofftemperatur wirtschaftlich nicht durchführbar ist, müssen reaktivierte Zellen in lebendem Zustand abgegeben werden. Transportgefäße mit Zellen und Medium müssen hermetisch versiegelt werden, um die Sterilität während des Transports zu gewährleisten. Pflanzenzelllinien werden unter Kultivierungsbedingungen heterotrophiert, d.h. sie sind photosynthetisch inaktiv und verwenden Zucker als Kohlenstoffquelle, der über das Kulturmedium geliefert wird. Als Konsequenz produzieren sie Kohlendioxid, anstatt es zu konsumieren. Das VisiSens™ CO2-Bildgebungssystem wurde zur Visualisierung von Kohlendioxidveränderungen in einem luftdicht abgeschlossenen Transportsystem eingesetzt. Unser Ziel war es, die metabolische Aktivität zu überwachen, die die Fitness lebender Zellen anzeigt, indem die Akkumulation des metabolischen Endproduktes Kohlendioxid nachgewiesen wird. Die Überwachung von Kohlendioxid wurde durch pH- und O2-Aufzeichnungen im gleichen System ergänzt.
Material & Methoden
Pflanzenzellen aktiv wachsender Flüssigkulturen von Solanum tuberosum Desirée und Nicotiana tabacum BY2 wurden zweimal mit Medium (ohne CaCl2) gewaschen. 10 ml jeder Kultur wurden in ein Falcon-Röhrchen (50 ml) gefüllt und mit 3 % Alginatlösung auf 30 ml aufgefüllt. Die Mischung aus Zellen und Alginat wurde vorsichtig gemischt und dann unter Verwendung einer Pipette mit zugeschnittener Spitze in eine 100 mmol CaCl2-Lösung getropft. Nach 20-minütigem Rühren wurde der Überstand verworfen und die Alginatperlen zweimal mit CaCl2-freier Lösung gewaschen. Frisch immobilisierte Pflanzenzellen wurden in Kunststofffläschchen überführt, die mit pH-, O2- und CO2-Sensoren ausgestattet waren (Fig. 2). Vier Alginatperlen pro Fläschchen wurden mit 1 ml Pflanzenmedium übergossen, bevor die Fläschchen luftdicht verschlossen wurden. Als Kontrollen wurden die jeweiligen Pflanzenmedien ohne Zellen sowie die Sensorfolien allein gemessen. Alle Proben wurden im Dunkeln bei Raumtemperatur gelagert und nur zur Überwachung entnommen. Immobilisierte Zellen wurden zehn Tage lang überwacht.

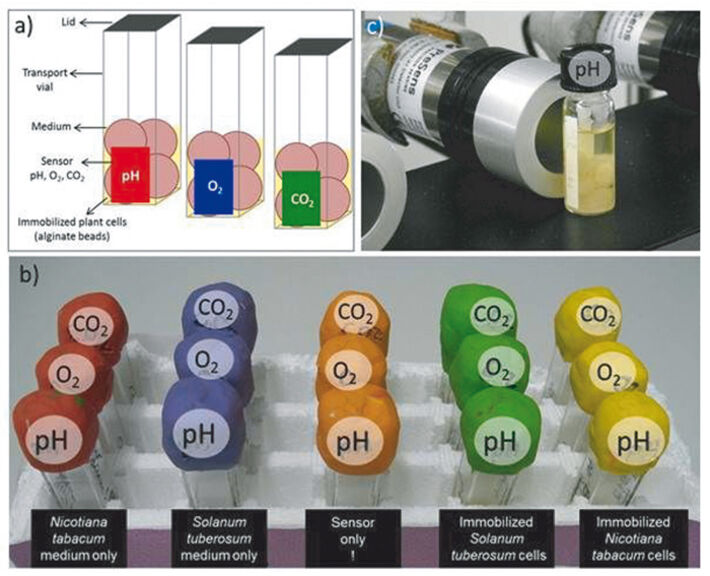
Metabolische Aktivität von immobilisierten Pflanzenzellen
Änderungen von CO2, pH und O2 in einem luftdicht abgeschlossenen System, das immobilisierte Pflanzenzellen von S. tuberosum bzw. N. tabacum enthält, wurden zehn Tage lang mit VisiSens™ überwacht (Abb. 3). In Abb. 3a sind Änderungen der CO2-Konzentration im flüssigen Medium, das S. tuberosum-Kügelchen umgab, gezeigt. Innerhalb von zehn Tagen Monitoring (bestehend aus 20 Einzelmessungen) konnte ein starker CO2-Anstieg registriert werden. Folglich nahm der pH-Wert ab und das Medium wurde saurer. Darüber hinaus beobachteten wir einen deutlichen Verbrauch von O2 im Laufe der Zeit (Abb. 3a). 3b zeigt die Veränderungen von CO2, pH und O2 im gleichen System unter Verwendung von immobilisierten Pflanzenzellen von N. tabacum. Insgesamt 14 Messungen ergaben einen Anstieg von CO2 im flüssigen Medium, das N. tabacum umgab. Wie in Gefäßen mit S. tuberosum führte der steigende CO2-Gehalt dazu, dass das Pflanzenmedium sauer wurde. Im Vergleich zu S. tuberosum war der O2-Verbrauch und die CO2-Produktion von N. tabacum jedoch schwächer. Die Überwachung der Fitnessparameter von lebenden Zellen in versiegelten Transportvials mit bildgebender Technologie zeigte eindeutig die metabolische Aktivität immobilisierter Zellen. Nach zwei Wochen der Überwachung begannen Pflanzenzellen, in den luftdicht verschlossenen Gefäßen aus den Alginatperlen zu wachsen. Dies zeigte, dass die Zellen noch am Leben waren und bestätigte, dass die detektierten Parameteränderungen auf die metabolische Aktivität der Zellen zurückzuführen waren.
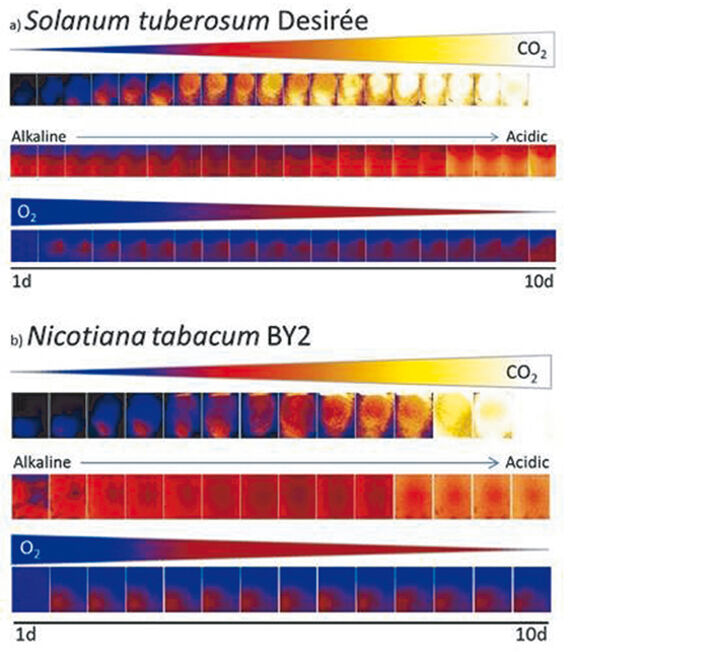

pH Veränderungen in den Transportbehältern
Während der 10-tägigen Überwachung beider Ansätze, d. h. immobilisierten Zellen von S. tuberosum und N. tabacum lag der pH-Wert des umgebenden Mediums in den Transportvials im Bereich von etwa 6,5 bis 4 (Fig. 4). Zu Beginn war ein offensichtlicher pH-Unterschied zwischen Medium (etwa pH 5) und Fläschchenatmosphäre (pH 6 bis 6,5) feststellbar (Fig. 4c, h). Nach 10 Tagen hatte der pH-Wert beider Phasen in beiden Ansätzen einen Wert unter 4,5 (Fi. 4e, j). Kontrollen (nur Medium / Sensoren) zeigten keine relevanten Änderungen.
Zusammenfassung
Der Versand von Pflanzenzelllinien kann je nach Bestimmungsort mehrere Tage dauern. Während des Transports müssen die Zellen in einer dicht verschlossenen Umgebung bleiben, um Sterilität sicherzustellen. Es ist schwierig, den Zeitpunkt vorherzusagen, zu dem die Erschöpfung der Nährstoffe (Saccharose, O2) oder die Ansammlung von Endprodukten (CO2) das Überleben der Zellen unter diesen Bedingungen limitiert. Mit VisiSens™ konnten wir erstmalig die metabolische Aktivität immobilisierter Pflanzenzellen in einem hermetisch verschlossenen Transportbehälter beobachten, da das System nicht-invasive Messungen erlaubt. Unsere Monitoring-Ansätze zeigten, dass immobilisierte Pflanzenzellen auch nach 10 Tagen Lagerung in einem geschlossenen System metabolisch aktiv sind und das Wachstum von Pflanzenzellen bestätigte diese VisiSens™ Beobachtungen. Da ein Transport normalerweise weniger als zehn Tage dauert, kann die Fitness der Zellen garantiert werden.



