Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
O2, pH und CO2 Überwachung in mikrofluidischer Säugerzellkultur
Bioprozessoptimierung für kultiviertes Fleisch mit SensorPlugs
Vasa Radonic, Ivana Podunavac, Mila Djisalov, Teodora Knezic, Ivana Gadjanski
BioSense Institute, Novi Sad, Serbien
Wir haben die Wirksamkeit von PreSens SensorPlugs zur Überwachung von Kultivierungsprozessen mit Säugerzellen in mikrofluidischen Bioreaktoren (MBs) mit integrierten Sensoren getestet. MRC-5-Fibroblasten (ATCC® CCL-171 ™) wurden als Modell für adhärente Säugetierzellen anstelle primärer Zellkultur von tierischen Satellitenzellen / Myoblasten verwendet. SensorPlugs zeigten, dass sie gut geeignet sind anhaftende Säugetierzellkulturparameter innerhalb des MB über die Zeit zu überwachen.
Das Zellkulturmedium ist der bedeutendste Kostentreiber für die Kulturfleischproduktion. Die Optimierung des Designs und der Instrumentierung der Bioreaktoren durch zusätzliche Überwachungsfunktionen mittels Sensoren kann dazu beitragen, diese Kosten zu senken und die maximale Zellproduktionskapazität pro Einheit mittleren Volumens zu erreichen. Scale-Down-Ansätze werden seit langem in Bioprozessen angewendet, um Scale-Up-Probleme zu lösen. Miniaturisierte Bioreaktoren haben sich als Instrument zur Gewinnung prozessrelevanter Daten in der frühen Prozessentwicklung bewährt. Wir haben dieses Prinzip angewendet, d. h. den "Lab-on-a-Chip"-Ansatz (LoC) bei der Entwicklung einer neuen Generation kostengünstiger Sensoren zur Überwachung verschiedener Zellkulturparameter wie Biomasse, Ammoniak und Glutamin in Zellkulturmedien. Wir haben unsere speziell gefertigten mikrofluidischen Bioreaktoren verwendet, die mit unserem impedimetrischen Sensor und einem optischen Sensor in Kombination mit den von PreSens bereitgestellten SensorPlugs für O2, CO2 und pH ergänzt wurden. Die Hauptidee unseres Projekts war es, herauszufinden, welche Prozesse im mikrofluidischen Bioreaktor ablaufen, und die Auswirkungen auf das Zellverhalten, die Lebensfähigkeit der Zellen und die Wirksamkeit der Reagenzien zu quantifizieren. Wir haben die Wirksamkeit von PreSens SensorPlugs zur Überwachung von Bakterien- und Säugetierzellkulturen in mikrofluidischen Bioreaktoren getestet. Darüber hinaus führten wir eine Reihe von Pilotversuchen mit menschlichem Speichel durch, um die Anwendung der Sensoren für die Geschmacksbewertung des Endprodukts des kultivierten Fleisch-Bioprozesses zu erweitern. Hier werden unsere Ergebnisse für die Zellkulturüberwachung gezeigt.
Material & Methoden
Die mehrschichtigen MB-Chips wurden unter Verwendung der transparenten und biokompatiblen Materialien Glas und PMMA hergestellt. Die obere und die mittlere Schicht wurden aus PMMA hergestellt und die Verbindungsschichten wurden unter Verwendung von doppelseitigen 3M-Klebebändern (3M GPT-020F, St. Paul, MN 55144-1000, Minneapolis, USA) hergestellt. Die untere Schicht des Chips für die Zellkultur bestand aus Glas, wo der Impedanzsensor mit der handelsüblichen Agfa-Gevaert N.V.-Nanosilbertinte mit 15% Ag-Nanopartikeln und der leitfähigen Tinte unter mit einem piezokontrollierten Tintenstrahldruckers Fuji Dimatix DMP-3000 aufgedruckt wurde. Der Sensor wurde mit einer dünnen Schicht SU-8 3000 Microchem Resist bedeckt. Die oberste Schicht enthielt Einlass- / Auslasslöcher, deren Durchmesser zum Pipettieren der Probe während des Füllens des Chips angepasst waren. In die oberste Schicht wurden drei Löcher mit einem Durchmesser von 2,1 mm für die Montage der PreSens SensorPlugs eingebracht. Die Sensoren standen durch die Löcher in direktem Kontakt mit der Probe, was eine Echtzeitmessung der Parameter in der Probe ermöglichte. MRC-5-Fibroblasten (ATCC® CCL-171 ™) wurden als Modell eines adhärenten Zelltyps verwendet. Alle Experimente mit MRC-5-Fibroblasten wurden am Institut für Onkologie der Vojvodina, Sremska Kamenica, Serbien, durchgeführt. DMEM mit 10 % FBS wurde als Kultivierungsmedium verwendet.
Überwachung von O2, CO2 und pH während der Kultivierung
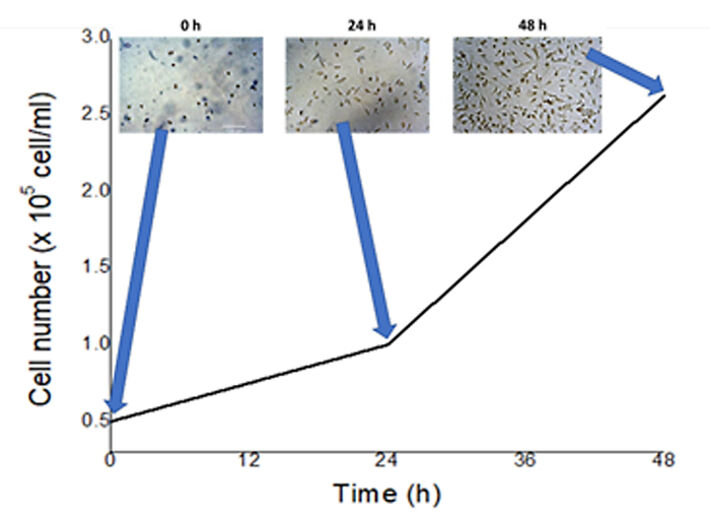
Bevor irgendwelche Messungen durchgeführt wurden, führten wir Biokompatibilitätstests der verwendeten Materialien für die Herstellung von MF-Chips durch. MRC-5-Zellen zur Kultivierung wurden in einer Konzentration von 50.000 Zellen/ml in die MF-Chips gegeben. Abbildung 1 zeigt die Ergebnisse der Kultivierung von MRC-5-Zellen während 48 Stunden; die Verdopplungszeit- und Wachstumskurve innerhalb des MF-Chips wurde berechnet. Es konnte festgestellt werden, dass die Zellen ohne zusätzliche Beschichtungsmittel gut am Glas hafteten. Dieser Zelltyp setzt sich schneller ab und bindet an das Substrat, was in der ersten Stunde nach der Inokulation am stärksten ausgeprägt ist. Die Gesamtzahl der nach 48-stündiger Kultivierung erhaltenen Zellen betrug 262.500 Zellen/ml mit einer Lebensfähigkeit von 95,45 %.
Die Biomassekonzentration wurde unter Verwendung von UV/VIS-Absorptionsspektren gemessen, die im Nahe-Infrarotbereich unter Verwendung eines Prozessspektrometers und einer faseroptischen Sonde auf der Oberseite des Mikrofluidik-Chips aufgezeichnet wurden. Da lebensfähige Zellen polarisierbar sind und als Dipole wirken, wurde die Impedanzmessung mit der optischen Messung kombiniert, um Informationen über die Zellkonzentration und eine Abschätzung der Lebensfähigkeit der Zellen zu erhalten.
In dem vorgeschlagenen Experiment werden impedimetrische und optische Messungen der Biomassekonzentration mit Messungen wesentlicher Zellwachstumsparameter kombiniert: pH, O2 und CO2. Die Zellkultivierung wurde in einem statischen Zellkultursystem durchgeführt, in dem sich Zellen nach dem Aussäen unter statischen Bedingungen an das Zellsubstrat anlagern können. Die Zellen hatten optimale Wachstumsbedingungen, aber die Medien mit Nährstoffen, die für das Fortschreiten des Kultivierungsprozesses wesentlich sind, waren begrenzt.
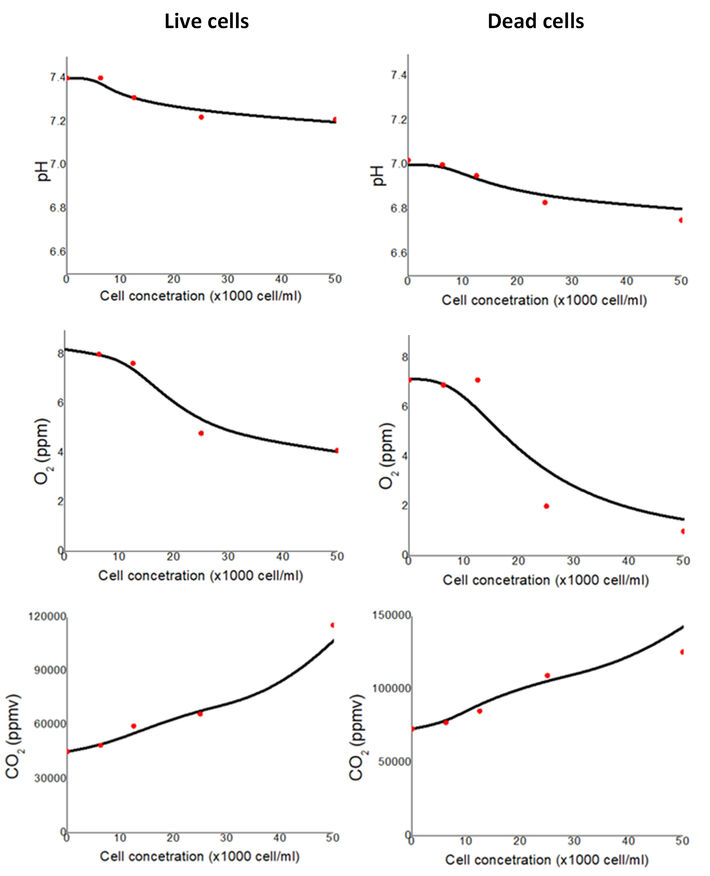
Die Messungen wurden innerhalb des Mikrofluidik-Chips mit unterschiedlichen Konzentrationen an lebenden und toten Zellen durchgeführt. Die Lebendzellparameter wurden durch mehrere Experimente überwacht und die Mittelwerte sind in Abbildung 2 dargestellt, während für die Totzellparameter die Zellen nach einer bestimmten Kultivierungszeit mit DMSO getötet wurden. Zu diesem Zweck haben wir 6250 Zellen/ml MRC-5-Zellen für die Kultivierung innerhalb der MF-Chips vorbereitet. DMEM, das 10% FBS enthielt, wurde als Kultivierungsmedium verwendet. Die pH-, O2- und CO2-Werte wurden im Mediums gemessen und die Zellen unter Verwendung eines Zytometers gezählt, während die Biomasse unter Verwendung eines integrierten impedimetrischen Sensors und optischer Spektroskopie im NIR-Bereich geschätzt wurde.
Der anfängliche pH-Wert (als wir Zellen innerhalb des MF-Chips ausgesät hatten) bei t = 0 min betrug etwa 7,4. Nach der Kultivierung der Zellen beobachten wir eine Ansäuerung der Kultur, eine Zunahme von % Kohlendioxid und eine gleichzeitige Abnahme von % Sauerstoff während der Inkubation. Für die geringere Konzentration an Zellen gab es keine signifikanten Änderungen in allen Parametern. Mit zunehmender Zellkonzentration stieg der CO2-Gehalt exponentiell an und O2 nahm exponentiell ab. Im Falle der toten Zellen wurde dem Medium DMSO zugesetzt, was zusätzlich eine Änderungen aller Parameter, insbesondere des pH-Werts, verursachte. Es konnten auch signifikante Unterschiede in den gemessenen Konzentrationen der Gase über die Zeit beobachtet werden.
Zusammenfassung
Basierend auf den vorgestellten Ergebnissen können wir den Schluss ziehen, dass die PreSens SensorPlugs eine bequeme Möglichkeit sind, grundlegende Parameter (O2, pH, CO2) in der mikrofluidischen Zellkultur zu überwachen. PreSens SensorPlugs bieten ein wichtiges Werkzeug für die Analyse des Scale-Down-Ansatzes und die Prozessüberwachung bei der Optimierung von Bioprozesskulturen. Zukünftige Experimente werden auf die kontinuierliche Überwachung und Optimierung von Kultivierungsprozessen gerichtet sein, wobei die Auswirkungen der Zellaktivität im Mikrobioreaktor sowie die Auswirkungen der Nährstoffe auf den Zellwachstumsfaktor untersucht werden. Die Forschung konzentriert sich auf die Ermittlung der Korrelation zwischen den Messwerten von pH-, O2- und CO2-Sensoren mit zusätzlichen Sensoren (impedimetrisch, optisch und elektrochemisch), die in mikrofluidische Bioreaktoren integriert sind, die wir am Institut zur Messung der Leitfähigkeit des Mediums, der Metabolite und der Biomasse entwickelt haben. Die Korrelation zwischen pH, O2 und CO2 mit Zellbiomasse und Lebensfähigkeit wird in zukünftigen Experimenten weiter untersucht.