Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Konstantin Bagnjuk
Process Manager USP Process Design, Rentschler Biopharma, Laupheim, Deutschland
In einem autoklavierbaren 10 l Tisch-Bioreaktor wurde ein Fed-Batch-Verfahren mit der Glutaminsynthetase-Knockout-CHO-Zelllinie von Horizon durchgeführt. Für die Online-Kulturüberwachung wurde ein neuartiges pCO2-Messsystem von PreSens verwendet, bei dem das Sensorelement in einem Bypass installiert war. Die Online-Messungen stimmten gut mit den mit Bioprofiler offline gemessenen pCO2-Werten überein.
Die Überwachung von Zellkulturparametern wie der Konzentration an gelöstem Sauerstoff, dem pH-Wert und der Konzentration an gelöstem CO2 ist wichtig, um die Produktqualität und -ausbeute sicherzustellen. Kleine Veränderungen in der Kulturumgebung können den Zellstoffwechsel, die Lebensfähigkeit und sogar das Glykosylierungsmuster von mABs beeinflussen. In Säugetierzellkulturen werden typischerweise niedrige Begasungsraten angewendet, um zu verhindern, dass das Medium schäumt und die Zellen durch Scherkräfte platzender Blasen geschädigt werden. Es wurden verschiedene Begasungsstrategien entwickelt, um eine ordnungsgemäße Sauerstoffversorgung zu gewährleisten und gleichzeitig Stress und Schaumbildung gering zu halten - insbesondere bei Bioreaktoren im Produktionsmaßstab (> 250 l). Bei diesem Vorgehen kommt es zu einer Ansammlung von gelöstem CO2, dem normalerweise durch Stripping des Mediums mit Stickstoff entgegengewirkt wird. Für das Stripping benötigt der Bioreaktor-Controller Online-CO2-Informationen, weswegen zuverlässige Messtechnologien für gelöstes CO2 gebraucht werden. Daher wurde ein neuartiges Messsystem evaluiert, das die Bestimmung der gelöstem pCO2 Konzentration im Kulturmedium in Echtzeit in einem 10 l Scale-Down-Modellprozess ermöglicht. Aufgrund des kleinen Reaktors und damit des geringen Gesamtmedienvolumens und des geringen hydrostatischen Drucks wären nur geringe CO2 Konzentrationen zu erwarten, dennoch sollte die Anwendbarkeit und Genauigkeit des Sensorsystems nachgewiesen werden.
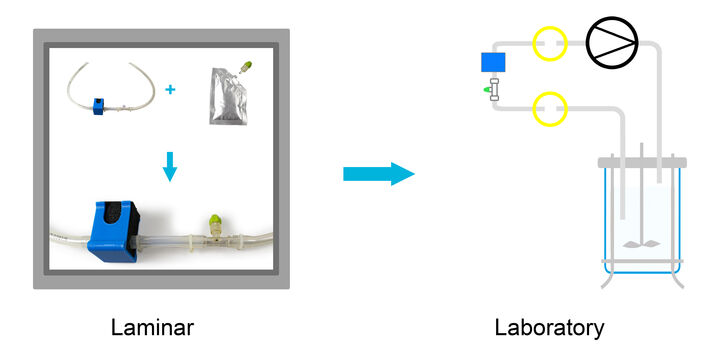
Das System besteht aus drei Komponenten: (i) einem ¼ ”C-Flex-Schlauch mit integrierter Durchflusszelle und Temperatursensor, die bestrahlt geliefert werden und in einen Bypass eingebaut werden können, (ii) einem optischen pCO2 Sensor, der am distalen Ende eines Sensorsticks befestigt ist, separat in einem Quetschbeutel mit physiologischer Kochsalzlösung verpackt ist und der über einen Luer-Anschluss in der Laminar-Bank in die Durchflusszelle integriert werden kann, (iii) ein optisches pCO2-Messgerät für pCO2- und Temperaturmessung, die über einen PC gesteuert wird (4-20 mA Ausgangsmodul verfügbar, aber in dieser Studie nicht verwendet). Die separaten Komponenten ermöglichen eine sichere und einfache Installation unter laminarer Strömung. Wenn der Bioreaktor-Aufbau fertig ist, können der optische CO2-Sensor und der Temperatursensor an das CO2-Messgerät angeschlossen werden. Dieses System zur pCO2-Überwachung wurde in einem CHO Fed-Batch-Verfahren getestet und gegen Offline-Messungen referenziert.
Material & Methoden
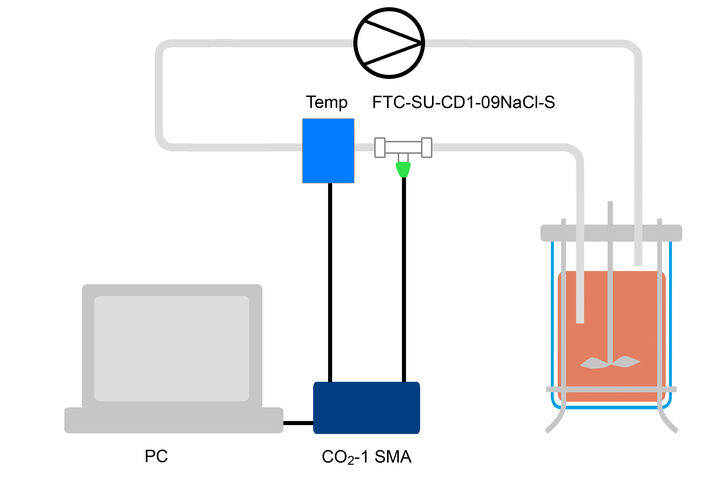
CHO GS-Knockout-Zellen (HorizonTM) wurden in standardisiertem Säugerzellkulturmedium in einem 10 l Rührkessel-Glasbioreaktor mit einer anfänglich lebensfähigen Zellkonzentration von 1,0 × 106 Zellen/ml gezüchtet. Das Fed-Batch-Verfahren wurde mit Begasung bei Bedarf und einem Temperatursollwert von 35,5 °C vor und 32 °C nach der Temperaturverschiebung am Tag 6 der Kultivierung durchgeführt. Temperatur und pCO2 wurden online mit einem von PreSens entwickelten Messaufbau überwacht. In einem Bypass wurde eine ¼ ”C-Flex-Baugruppe mit integrierter Durchflusszelle und Temperatursensor installiert. Der CO2 Sensorstick und der in die C-Flex-Baugruppe eingesetzte Temperatursensor wurden zur Online-Überwachung an das CO2-1 SMA Messgerät angeschlossen. Das Kulturmedium wurde mit einer peristaltischen Pumpe mit 60 ml/min durch den Bypass gepumpt. Die Zellzahl (Cedex HiRes, Roche CustomBiotech), der pH und der pCO2 (Bioprofiler pHOx, Nova) wurden über tägliche Offline-Messungen bestimmt.
Ergebnisse
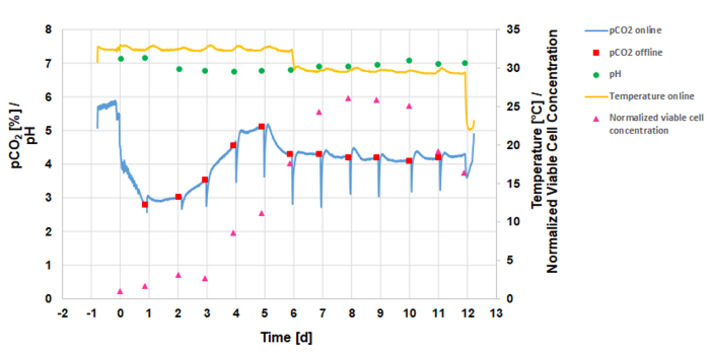
Abbildung 3 zeigt die online und offline bestimmten Kulturparameter im CHO Fed-Batch-Prozess. Die maximale lebensfähige Zellkonzentration von 2,61 × 107 Zellen/ml wird am achten Tag erreicht. Die online im Bypass mit dem PreSens Messsystem gemessene Temperatur liegt ca. 2 °C unter den Temperatursollwerten von 35,5 °C vor und 32 °C nach der Temperaturverschiebung. Die Online-Messungen zeigen jedoch deutlich die Temperaturverschiebung am 6. Tag, die durchgeführt wird, um die Lebensfähigkeit und Produktivität der Zellen zu verlängern. Das Verfahren wurde bei pH 7 durchgeführt. Der pH-Wert fällt während der ersten 5 Tage der Kultivierung aufgrund der Stoffwechselaktivität der Zellen leicht ab.
Während der ersten fünf Tage der Kultivierung steigt der pCO2-Gehalt im Kulturmedium langsam von 3 % auf 5 %. Die Einbrüche bei den Online-pCO2-Messungen werden durch die täglichen Substratzugaben verursacht, die das Kulturmedium verdünnen und den pCO2-Spiegel verringern. Nach Erreichen der maximal lebensfähigen Zellkonzentration bleibt die pCO2-Konzentration bei 4,2 ± 0,1 %. Die Grafik zeigt, dass online gemessene pCO2-Werte gut mit den täglichen Offline-pCO2-Messungen übereinstimmen.
Zusammenfassung
Die Evaluierung des neuen PreSens pCO2-Messaufbaus für Bioreaktor-Bypässe ergab, dass dieses System genaue Echtzeitdaten für die Kulturkontrolle liefert. Die C-Flex-Konnektivität dieses speziellen Loops mit optischer Messtechnologie ermöglicht die sichere Installation des Sensors in autoklavierten Tisch- oder Einweg-Bioreaktoren, sofern diese mit dem richtigen C-Flex-Schlauch-Gegenstück ausgestattet sind.
Danksagung
Das zu diesem Bericht führende Projekt wurde von der gemeinsamen Initiative Innovative Medicines Initiative 2 im Rahmen der Finanzhilfevereinbarung Nr. 777397 finanziert. Dieses gemeinsame Unterfangen erhält die Unterstützung des Forschungs- und Innovationsprogramms Horizon 2020 der Europäischen Union und EFPIA.
Haftungsausschluss
Der Bericht gibt die Meinung der Autoren wieder, und weder IMI noch die Europäische Union, EFPIA oder assoziierte Partner sind für die Verwendung der darin enthaltenen Informationen verantwortlich.




