Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Online Sauerstoffüberwachungssystem
Nicht-konventionelle Steroidfermentation in Mikrotiterplatten
Marques M.P.C., Cabral J.M.S., Fernandes P.
Institute for Biotechnology and Bioengineering, Centre for Biological and Chemical Engineering, Instituto Superior Técnico, Lisboa, Portugal
Ein Schlüsselfaktor bei der Optimierung und Entwicklung von Bioprozessen ist die Überwachung der Fermentation, um unter anderem Parameter wie Sauerstoff, pH-Wert und Kohlendioxid in Echtzeit zu quantifizieren. Die Überwachung mittels SDR erlaubt es, den zeitlichen Verlauf der Fermentation zu verfolgen und Prozessparameter auf gewünschte Werte einzustellen. Die Online-Überwachung in gerührten Behältern, insbesondere Fermentern, ist eine weit verbreitete Vorgehensweise, wurde jedoch aufgrund technischer Einschränkungen selten in geschüttelten Systemen angewendet.
Nicht-invasive Sauerstoffdetektion
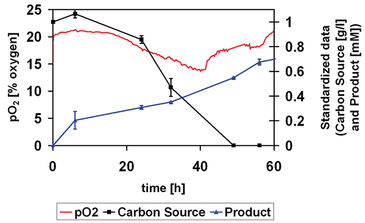
Der SDR SensorDish® Reader (Abb. 1) ermöglicht die nicht-invasive Online-Überwachung von Sauerstoff und pH während Fermentationsprozessen in 24-Well Mikrotiterplatten. In der vorliegenden Arbeit wurde diese Vorrichtung getestet und verwendet, um den zeitlichen Verlauf einer mehrstufigen Biotransformation sowohl in wässrigen (Abb. 2) als auch in organisch-wässrigen Systemen mit zwei Flüssigphasen (Abb. 3) zu verfolgen. Als Modellsystem für Sitosterol-Seitenkettenspaltung zu Androstendion (AD) wurde Mycobacterium sp. NRRL B-3805 ausgewählt (Marques et al., 2007).
Material & Methoden
Mycobacterium sp. NRRL B-3805-Zellen wurden in 24-Well Mikrotitterplatten mit integrierten Sauerstoffsensoren (OxoDishes®) kultiviert und für einen Zeitraum von etwa 60 Stunden unter Schütteln mit 200 U/min bei 30 °C inkubiert. Das verwendete synthetische wässrige Kulturmedium wurde im Vorfeld definiert (Marques, et al., 2007). Um eine Verdunstung des Mediums zu verhindern, wurde AeraSeal Dichtungsband verwendet. Die Sauerstoffkonzentration im Kulturmedium wurde während des gesamten Kulturzeitraums mit der SensorDish® Reader Software online überwacht. Der Sauerstoffverbrauch wurde mit dem Verbrauch der Kohlenstoffquelle und der Produktbildung, die offline durch HPLC gemessen wurden (Marques et al., 2007), unter Verwendung von Opfer-Wells verglichen. Hinsichtlich der Wahl des Lösungsmittels wurden die Zellen in Gegenwart einer zweiten Phase, bestehend aus mehreren organischen Lösungsmitteln, kultiviert. Das Wachstum wurde durch Sauerstoffverbrauch überwacht.
Präzise Sauerstoffprofile
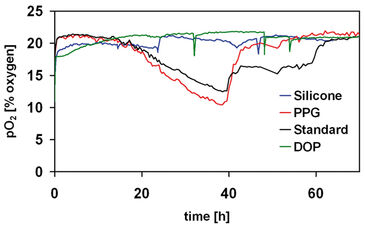
Das Sauerstoffverbrauchsprofil (Abb. 2) zeigt deutlich die unterschiedlichen Wachstumsphasen der Fermentation. Wir beobachteten eine Lag-Phase von etwa 15 Stunden, in der die Sauerstoff- und Substratmengen in etwa unverändert blieben. Nach dieser Zeit wurde neben der Produktbildung ein signifikanter Sauerstoff- und Kohlenstoffquellenverbrauch beobachtet. Schließlich gingen die Zellen in die stationäre Phase über, was durch den Anstieg des pO2 bei gleichzeitiger Erschöpfung der Kohlenstoffquelle angezeigt wird. Die Wirkung der Lösungsmittel, die als Substratträger für das Mykobakterien-Wachstum verwendet wurden, wurde für diese spezielle Biotransformation ebenfalls mit der SensorDish® Reader-Technologie untersucht (Abb. 3). Lösungsmittel wie Silikon, Dioctylphthalat (DOP) und Propylenglycol (PPG) wurden getestet und das Wachstum wurde mit dem in einem herkömmlichen Medium (Standard) verglichen. Frühere Studien zeigten, dass DOP chemisch mit Mikrotiterplatten wechselwirken kann (Marques, et al., 2007). Mit dem OxoDish® ist ein ähnliches Phänomen aufgetreten, jedoch blieb der Sensor zur Sauerstoffüberwachung unbeeinflusst. Wir konnten das bestätigen, indem wir die Schüttelbewegung abrupt stoppten und die Sensorreaktion beobachteten. Der Abfall der Sauerstoffwerte nach dem Stoppen und die anschließende Wiederherstellung der Ausgangswerte zeigen den Ansprechwert. Diese Technik wurde auch verwendet, um die Reaktion des Sensors in Gegenwart von Silikon zu bestätigen. In beiden Lösungsmitteln gab es kein Zellwachstum. Wir konnten bestätigen, dass Propylenglycol ein geeignetes Lösungsmittel ist (Stefanov et al., 2006), wie das identische Wachstumsprofil zeigte, das für Zellen ohne organische Lösungsmittel aufgezeichnet worden war.
Überwachung des zeitlichen Ablaufs der Fermentation
Beide Ergebnisse zeigen die Stabilität und Flexibilität der SensorDish® Reader-Technologie als geeignetes Werkzeug zur Überwachung des zeitlichen Verlaufs der Fermentation, auch in nicht-konventionellen Medien. Die erhaltenen Daten stimmen eng mit denen überein, die in herkömmlichen Vorrichtungen gesammelt wurden, nämlich gerührten Fermentern und großen Schüttelkolben (Daten nicht gezeigt). Diese Ergebnisse tragen dazu bei, dass Mikrotiterplatten als Grundlage für repräsentative Screening-Systeme benutzt werden, und somit die Reproduzierbarkeit über alle Maßstäbe hinweg sicherstellt ist. Diese Fähigkeit zeigt die Eignung dieser Plattform für die Durchführung biokatalytischer Studien in komplexen Biotransformationssystemen, z. B. für die Prozessentwicklung und -verbesserung. Da der SensorDish® Reader eine hohe Anzahl paralleler Experimente zulässt, ist es möglich, schneller das gewünschte Ergebnis zu erzielen, wodurch nicht nur die damit verbundenen Kosten, sondern auch der Arbeitsaufwand reduziert werden.
Referenzen
Marques, M. P. C., de Carvalho, C. C. C. R., Claudino, M. J. C., Cabral, J. M. S., Fernandes, P. (2007) On the feasibility of the microscale approach for a multi-step biotransformation: sitosterol side-chain cleavage. J. Chem. Technol. Biotechnol., 82, 856 - 863.