Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Sauerstoff- und pH-Überwachung Deep Well OxoDishes® und HydroDishes®
Evaluierung der optimalen Wachstumsbedingungen für geschüttelte Hefekulturen

Thomas Grimm
BIOWORX, Berlin, Deutschland
In dieser Studie wurden verschiedene Hefekultivierungen in Deep Well OxoDishes® und HydroDishes® untersucht. Kultivierungen wurden mit variierenden Volumina durchgeführt, um die optimale Wachstumsbedingungen in den Platten mit 24 Wells und minimale Volumina für das Sensorauslesen mit dem SDR SensorDish® Reader bei 200 U/min zu bestimmen. Darüber hinaus wurden Batch und Fed-Batch Medien mit unterschiedlichem Glukosegehalt und Fütterungsraten bewertet. Die Ergebnisse zeigten, dass in Volumina von 1,25 ml/Well bis 3 ml/Well Sauerstoff- und pH-Werte mit dem SDR abgelesen werden konnten, obwohl bei geringerem Volumen ein stärkeres Rauschen in den Messungen beobachtet wurde. In den Deep Well-Platten konnten über 72 Stunden stabile Messwertaufzeichnungen durchgeführt werden. Füllvolumina von 1,25 ml und 1,5 ml zeigten eine optimale Sauerstoffversorgung und bestes Wachstum.
PreSens Deep Well OxoDishes® und HydroDishes® ermöglichen online Sauerstoff- und pH-Überwachung in geschüttelten Kulturen mit dem SDR SensorDish® Reader. In den folgenden Experimenten wurde die Hefe Pichia guilliermondii in diesen 24-Well Platten kultiviert. Ziel dieser Studie war es, die Eignung der Deep Well Oxo- und HydroDishes® zur Überwachung mikrobieller Kulturen, zur Untersuchung von Wachstumsprofilen und zur Bestimmung der minimalen Füllvolumina, bei denen ein Sensorauslesen bei einer Schüttelgeschwindigkeit von 200 U/min möglich ist, zu bewerten.
Material & Methoden
Der SDR SensorDish® Reader wurde zur Online-Überwachung von Sauerstoff und pH-Wert von Hefekulturen in Deep Well Oxo- und HydroDishes® (OD24-DW, HD24-DW, PreSens) - mit Abdeckungen (Applikon) zur Homogenisierung von Sauerstoffeintritt und Verdunstung - eingesetzt. Das System wurde in einem Thermoshaker (Gebhardt) mit dem System Duetz Klemmsystem (Applikon, Abb. 1) montiert. Kultivierungen wurden bei 200 U/min und 50 mm Amplitude durchgeführt. Das Fed-Batch Medium EnPresso (Biosilta) und das Batch Medium YED wurden mit verschiedenen Kulturvolumina pro Well wie folgt verwendet: Reihe 1 = 1,25 ml, Reihe 2 = 1,5 ml, Reihe 3 = 1,75 ml, Reihe 4 = 2,0 ml, Reihe 5 = 2,5 ml und Reihe 6 = 3 ml. Das erste Experiment sollte zeigen, wie P. guill. in EnPresso Fed-Batch Medium bei unterschiedlichen Kulturvolumina wächst. In einem zweiten Experiment wurde das Hefewachstum in Batch Medium YED mit entweder 20 g/l oder 60 g/l Glucose untersucht.
Überwachung Mikrobieller Kulturen
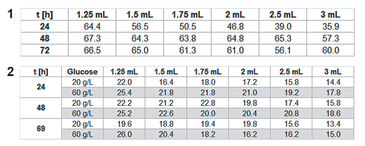
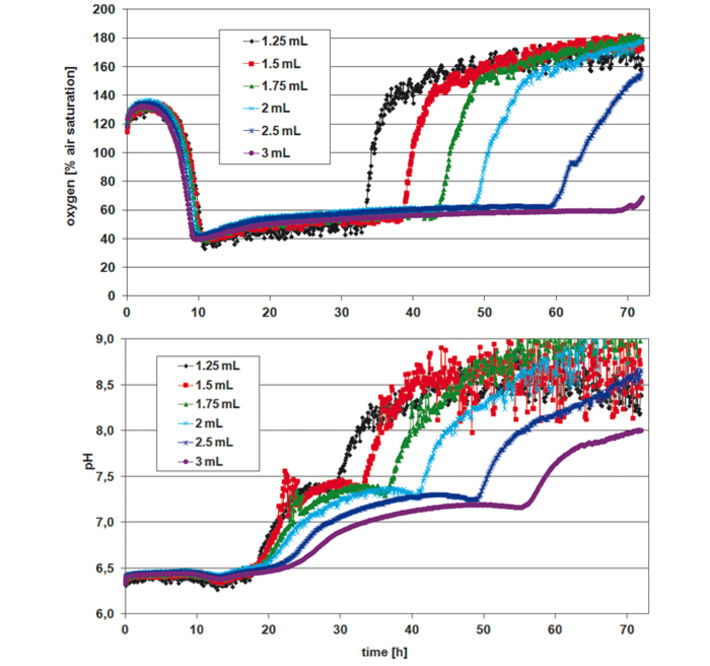
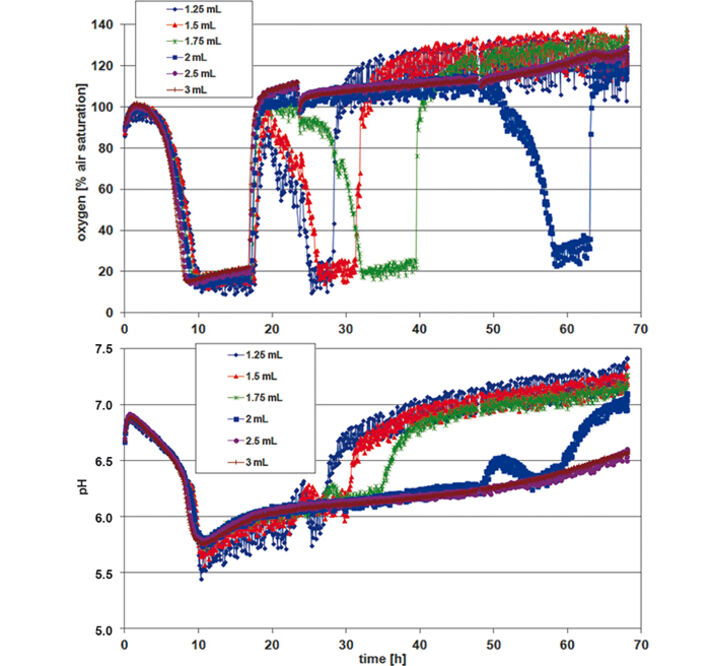
Zur Beurteilung von P. guill. in EnPresso Medium wurde die optische Dichte (OD600) nach 24, 48 und 72 h gemessen, wobei die Mittelwerte für jede Reihe / Kulturvolumen berechnet wurden (Tab. 1). Ideales Wachstum und optimale Sauerstoffversorgung zeigten sich bei einem Füllvolumen von 1,25 ml. Die maximale Zelldichte wurde nach 48 Stunden erreicht. Mit steigendem Kulturvolumen in den Wells nahm die Sauerstoffversorgung ab und das Wachstum wurde verlangsamt. Bei kleineren Kulturvolumina war dagegen ein erhöhtes Rauschen in den Sauerstoff- und pH-Werten zu erkennen (Abb. 2). Die Kinetik kann jedoch sehr gut verglichen werden. Die Sauerstoffkinetik zeigt Sauerstoffverbrauch für etwa 10 Stunden; danach deuten minimale Sauerstoffwerte auf eine hohe metabolische Aktivität und Wachstum hin. Aufgrund unterschiedlicher Sauerstoffeinträge bei unterschiedlichen Füllvolumina weisen die Proben unterschiedliche Wachstumsraten auf. Glukose ist zuerst in den Proben mit dem schnellsten Wachstum (1,25 ml) nach ca. 32 Stunden aufgebraucht, und in den Proben mit dem langsamsten Wachstum (3 ml) nach etwa 70 Stunden. Dies zeigt sich durch einen Sauerstoffanstieg aufgrund der geringeren Zellaktivität bei konstantem Sauerstoffeintrag. Die pH-Kinetik zeigt für die ersten 18 h einen konstanten pH-Wert von 6,5. Danach findet das Wachstum unter Sauerstofflimitierung statt, was zu einem pH-Anstieg auf 7,5 führt, und zwar aufgrund des Verbrauchs von komplexen Mediumkomponenten wie Pepton, wodurch NH3 entsteht. Auch hier ändert sich nach ca. 30 h die Kinetik, zuerst für die Proben mit dem stärksten Wachstum (1,25 ml) und zuletzt für die Proben mit dem langsamsten Wachstum (3 ml). Darauf folgt eine zweite pH-Zunahme. Da der pH-Sensor seine obere Messgrenze bei pH 8,5 hat, sind die Werte um und über diesem pH-Wert sehr verrauscht. Bei der Kultivierung von P. guill. in YED Batch Medium mit 2 verschiedenen Glucosegehalten wurde die optische Dichte nach 24, 48 und 69 h bestimmt (Tab. 2). Die Ergebnisse zeigen ein besseres Wachstum in Medium, das 60 g/l Glucose enthielt. Hier wurden höhere Zelldichten und Wachstum über längere Zeiträume erreicht. Wiederum zeigten SDR-Messungen stärkeres Rauschen bei niedrigeren Kulturvolumina. Beide Sauerstoffkinetiken mit 20 und 60 g/l Glucose zeigen für 10 h eine Sauerstoffabnahme (Abb. 3 + 4, oben). Proben mit einem höheren Glucosegehalt zeigen jedoch ein längeres und stabileres Wachstum bei minimalem Sauerstoff als Proben mit weniger Glucose. Nach 32 Stunden steigt der Sauerstoffgehalt in 60 g/l Glukose, aufgrund von Glukosemangel und damit geringerer Zellaktivität. Bei Medium mit weniger Glucose erhöht sich der Sauerstoffgehalt bereits nach 18 h wieder. Diesem folgt eine weitere Abnahme und Zunahme, was auf den Verbrauch eines zweiten Substrats hindeutet. Der pH-Wert sinkt von etwa 6,8 auf 5,5 für beide Glucosekonzentrationen in den ersten 10 Stunden. Nach diesem Minimum steigt er sofort wieder auf ca. 6.0 bis 6.5. Bei hoher Glukosekonzentration bleibt der pH-Wert für weitere 10 Stunden auf diesem Wert und beginnt dann wieder leicht anzusteigen. Proben mit niedriger Glukosekonzentration zeigen eine Kinetik, die mit der Sauerstoffkurve vergleichbar ist: Der pH-Wert steigt für die höchste Zellkonzentration (1,5 mL) nach 20 h schneller an und fällt dann wieder ab, verursacht durch die NH3-Produktion aufgrund des Verbrauchs einer zweiten Medienverbindung. Vergleicht man das Fed-Batch Medium EnPresso mit dem Batch Medium YED, zeigen OD-Messungen mit dem gleichen Inokulum ein besseres Wachstum in EnPresso (Daten nicht gezeigt). Die Sauerstoffkinetik sieht ähnlich aus, vorausgesetzt, dass genügend Glucose im Batch Medium vorhanden ist. Der pH-Wert bleibt in EnPresso für mehr als 10 Stunden konstant während er im Batch Medium schnell abnimmt.

Zusammenfassung
In den Deep Well Oxo-und HydroDishes® können auf dem SDR bei 200 U/min Schüttelfrequenz stabile Messaufzeichnungen und reproduzierbare Kultivierungen der Mikroorganismen durchgeführt werden. Geringere Probenvolumina führen aufgrund des höheren Sauerstoffeintrags zu höheren OD. Die Experimente zeigten, dass das optimale Arbeitsvolumen für die Hefezüchtung in den Deep Well-Platten 1,25 - 1,5 ml beträgt. Obwohl Messungen bei niedrigen Füllvolumina ein höheres Rauschen zeigen, können wertvolle Daten gesammelt werden, die Informationen über den Kulturstatus und den Medienverbrauch liefern.