Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Sauerstoffmessung in Suspensionskultur angeborener Immunzellen
In vitro Monitoring mit Fibox 4 und optischen O2 Sensorspots
Helene Möllerherm, Katja Branitzki-Heinemann, Maren von Köckritz-Blickwede
Institut für Physiologische Chemie, Research Center for Emerging Infections and Zoonosis (RIZ) , Tierärztliche Hochschule Hanover, Deutschland
Wir beschreiben hier Daten zu Sauerstoffmessungen in Suspensionkultur von Zellen des angeborenen Immunsystems: Primäre Mastzellen aus dem Knochenmark der Maus, und aus Blut gewonnene primäre humane Neutrophile. Zuerst bestimmten wir den Sauerstoffgehalt während des Langzeit-Differenzierungsprozesses von Knochenmarks-Mastzellen mit etwa 7 % O2 (53 mmHg), was den Bedingungen im Gewebe innerer Organe entspricht (Teil 1, veröffentlicht in [5]). Darüber hinaus wurden Kurzzeit-Inkubationen von Mastzellen und Neutrophilen unter hypoxischen Bedingungen (1 % O2, 7 mmHg) untersucht, um diese in Studien zur Wirt-Pathogen-Interaktion zu verwenden (Teil 2, veröffentlicht in [6, 7]).
Zellen des angeborenen Immunsystems wirken als unmittelbare Wirtsabwehr gegen bakterielle Infektionen. Bei einer Infektion werden im Gewebe anwesende Immunzellen, wie Mastzellen, aktiviert und entlassen proinflammatorische Botenstoffe, die die Aktivierung weiterer Immunzellen steuern. Neutrophile sind die ersten Zellen des angeborenen Immunsystems die zum Ort der Infektion transmigrieren und die Abtötung der eindringenden Pathogene steueren. Die meisten Studien zur Funktion angeborener Immunzellen werden in normalen Gewebekultur-Inkubatoren bei Standard-Kulturbedinungen und normaler Atmosphäre durchgeführt, bei etwa 21 % O2, 5 % CO2, 37 °C. Aber diese Bedingungen spiegeln nicht die physiologisch relevanten Bedingungen wider: Handelt es sich um gesundes Gewebe, hängt der physiologische Sauerstoffgehalt von der Lage des Gewebes ab, mit Konzentrationen z. B. um die 7 % in inneren Organen [1]. Im Falle einer Infektion und Entzündung, führt der Sauerstoffverbrauch der Pathogene und der übergewanderten Immunzellen zu hypoxischen Sauerstoffniveaus von bis zu unter 1 %, mit Folgen für die Zellfunktionen [2 – 4]. Um die Funktion angeborener Immunzellen für die Entwicklung von therapeuthischen oder prophylaktischen Interventionsstrategien besser zu verstehen, müssen Studien mit angeborenen Immunzellen unter physiologisch relevanten Bedinungen durchgeführt werden. Um diese Funktionen korrekt zu analysieren, wurden in dieser Studie die Sauerstoffniveaus währen in vitro Versuchen mit einem optischen Sauerstoffmesssystem von PreSens überwacht.
1. Langzeit-Inkubation von sich ausdifferenzierenden Mastzellen unter physiologischen Bedingungen (53 mmHg, 7 % O2)
Für Langzeitmessungen von Sauerstoff wurden hematopoietische Vorläuferzellen aus Knochenmark von C57BL/6 Wildtyp-Mäusen isoliert und in der Anwesenheit von Interleukin-3 für 39 Tage ausdifferenziert (Methode in [8] beschrieben). Dies wurde unter physiologischen Sauerstoff-Bedingungen (Hypoxie-Glovebox, Coy Laboratory Products, mit 7 % O2, 53 mmHg) im Vergleich mit atmosphärischen Bedinungen (normaler CO2 Inkubator, BINDER, 21 % O2) durchgeführt. Die Versuche zur Mastzell-Kultivierung in Physioxie wurden während der gesamten Differenzierungsperiode mit dem Fibox 4 und O2-Sensorspots (PreSens) überwacht.
Der Sauerstoffgehalt stabilisierte sich bei etwa 53 mmHg (7 % O2), während er bei normoxischen Bedingungen sowohl im Medium alleine als auch in Zellsupension über 120 mmHg (16 % O2) lag (Abb. 1). Dies bestätigt, dass Mastzellen während der Differenzierung nicht übermäßig viel Sauerstoff in den Kulturmedien verbrauchen. Um den Zeitraum zu bestimmen, den die Medien zur Äquilibrierung mit physioxischen und normoxischen Bedingungen benötigten, wurde der Sauerstoffgehalt bis zu 48 h unter Hypoxie (ohne voräquilibrierte Medien) gemessen. Der Sauerstoffgehalt glich sich nach 1.5 h an und blieb dann für bis zu 48 h konstant (Abb. 1) [5].
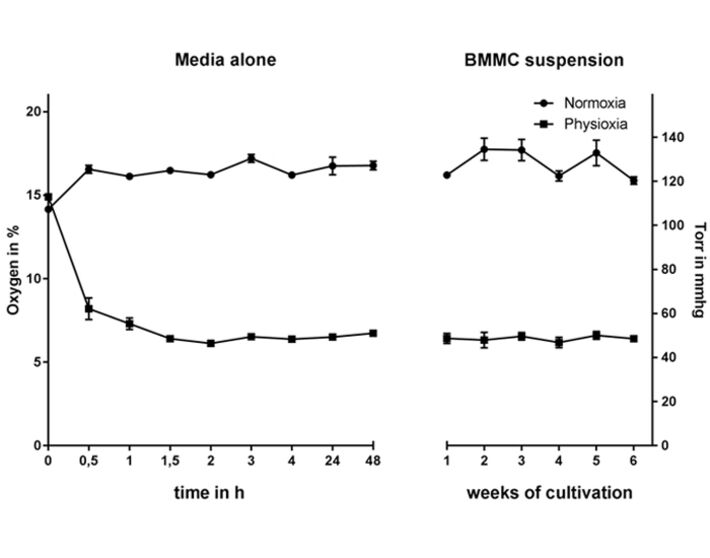
2. Kurzzeit-Inkubation von reifen Neutrophilen und Mastzellen unter hypoxischen Bedingungen (7 mmHg, 1 % O2)
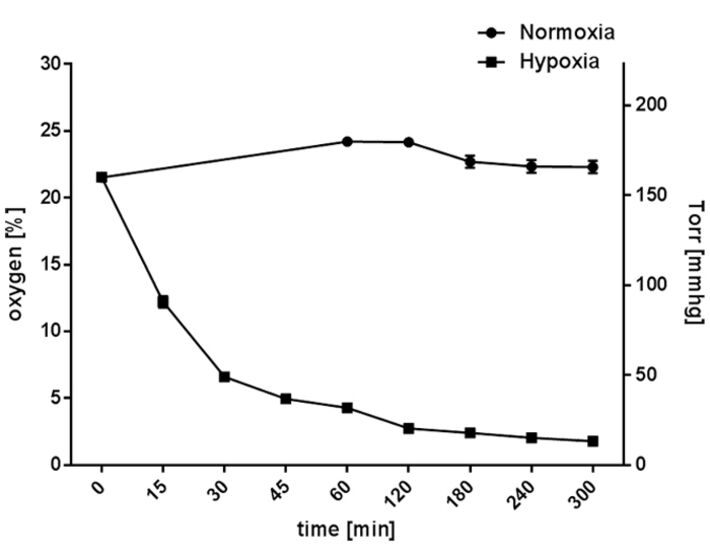
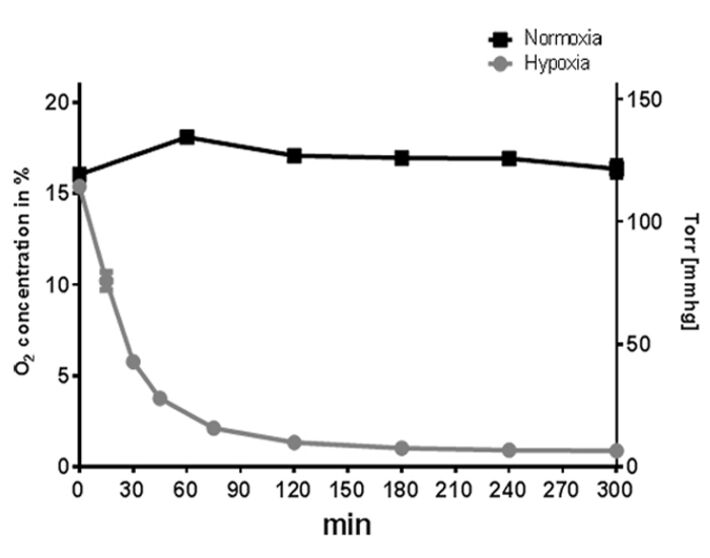
Frisch isolierte humane Neutrophile (Methode in [9] beschrieben) aus Blut gesunder Spender und ausdifferenzierte primäre Mastzellen aus Knochenmark der Maus wurden in 24-Well Suspensionskulturplatten (Sarstedt, Zellkulturplatten, Polystyren) ausgesät und unter hypoxischen Bedingungen (Hypoxie-Glovebox, Coy Laboratory Products, 7 % O2) im Vergleich zu normoxischen Bedingungen (CO2 Inkubator, BINDER, 159 mmHg, 21 % O2, 5 % CO2) inkubiert. Der Sauerstoffgehalt wurde über 5 h mit dem Fibox 4 und O2-Sensorspots SP-PSt3 (PreSens) gemessen.
Wenn sie unter Normoxie kultiviert wurden, behielten die Neutrophilenkulturen einen konstanten Sauerstoffpegel bei, der den atmosphärischen Zustand bei etwa 165 mmHg (22,3 ± 0,46% O2) widerspiegelte. Im Gegensatz dazu senkte die hypoxische Inkubation den Gehalt an gelöstem Sauerstoff in der Kultur innerhalb von 45 Minuten auf weniger als 37 mmHg (4,9 ± 0,2% O2) (ohne Voräquilibrierung der Medien) und führte zu einem Sauerstoffgehalt von weniger als 13,3 mmHg (1,79 ± 0,03 % O2) innerhalb von 5 h (Abb. 2). Im Vergleich dazu behielten Mastzellkulturen bei konstantem Sauerstoffgehalt in Normoxie einen Sauerstoffgehalt um 125 mmHg (16,9 ± 1,2% O2, Abb. 3). Hypoxische Inkubation senkte den gelösten Sauerstoffgehalt in den Kulturmedien innerhalb von 45 Minuten auf weniger als 28 mmHg (3,7 ± 0,7% O2) und führte innerhalb von 5 Stunden zu einem stabilen Gleichgewicht von weniger als 7 mmHg (0,9 ± 0,2 % O2, Abb. 3) [6, 7]. Durch den Vergleich dieser Sauerstoffmessungen von Suspensionszellkulturen mit adhärenten Zellkulturen, wie Epithelzellen, die als Monolayer kultiviert wurden [10], sind in beiden Suspensionskulturen (Neutrophile und Mastzellen) deutlich höhere Sauerstoffkonzentrationen messbar.
Kurze Zusammenfassung und Schlussfolgerung
Basierend auf den hier gezeigten Sauerstoffmessungen waren wir in der Lage nachzuweisen, dass Suspensionskulturen von angeborenen Immunzellen im Medium Sauerstoffniveaus ähnlich denen der Umgebungsbedingungen zeigen. Hierbei unterscheiden sie sich von den meisten Epithelzellkulturen die in Monolayer kultiviert werden [10, 11]. Daher bestätigen die hier aufgeführten Resultate, dass wenn man Neutrophile und Mastzellen unter hypoxischen Bedinungen inkubiert, der Sauerstoffgehalt zurückgeht und damit physiologische Sauerstoffbedingungen widerspiegelt, die in infizierten Geweben auftreten könnten. Basierend auf diesen experimentellen Bedingungen führten wir unter Verwendung einer Hypoxie-Glovebox mit konstantem Sauerstoffgehalt intensive in vitro Studien durch, die zeigten, dass Neutrophile und Mastzellen unterschiedlich reagieren, wenn sie unter physiologischen oder hypoxischen Bedingungen kultiviert werden. Das verdeutlicht wie wichtig es ist, die entsprechenden Sauerstoffbedingungen für Zellkulturstudien mit angeborenen Immunzellen zu verwenden. [5,7].
Referenzen
[1] Carreau, A. et al. Why is the partial oxygen pressure of human tissues a crucial parameter? Small molecules and hypoxia. J. Cell. Mol. Med. (2011) 15, 1239 / 1253
[2] Melican, K. et al. Bacterial infection-mediated mucosal signalling induces local renal ischemia as a defense against sepsis. Cell. Microbiol. (2008) 10, 1987 - 1998
[3] Campbell, E. L. et al. Transmigrating neutrophils shape the mucosal microenvironment through localized oxygen depletion to influence resolution of inflammation. Immunity (2014) 40, 66 - 77
[4] Schaffer, K. & Taylor, C. T. The impact of hypoxia on bacterial infection. FEBS J. (2015) 282, 2260 - 2266
[5] Möllerherm, H. et al. Differentiation and Functionality of Bone Marrow-Derived Mast Cells Depend on Varying Physiologic Oxygen Conditions. Front. Immunol. (2017) 8
[6] Branitzki-Heinemann, K. et al. Formation of Neutrophil Extracellular Traps under Low Oxygen Levels. Front. Immunol. (2016) 7, 518
[7] Möllerherm, H. et al. Hypoxia Modulates the Response of Mast Cells to Staphylococcus aureus Infection. Front. Immunol. (2017) 8, 541
[8] von Köckritz-Blickwede, M. et al. Phagocytosis-independent antimicrobial activity of mast cells by means of extracellular trap formation. Blood (2008) 111, 3070 - 3080
[9] Chow, O. A. et al. Statins enhance formation of phagocyte extracellular traps. Cell Host Microbe (2010) 8, 445 - 454
[10] Zeitouni, N. E. et al. Measuring oxygen levels in Caco-2 cultures. Hypoxia (Auckland, N. Z.) (2015) 3, 53 - 66
[11] Zeitouni, N. E. et al. Hypoxia Decreases Invasin-Mediated Yersinnia enterocolitica Internalization into Caco-2 Cells. PLoS One (2016) 11, e0146103


