Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
3D-Kulturen von Bandscheiben-Chondrocyten
Optosensorische Online-Überwachung der Sauerstoff- und pH-Kinetik
Karin Benz und Jürgen Mollenhauer
Regenerative Medizin II, NMI Reutlingen, Markwiesenstraße 55, 72770 Reutlingen, Deutschland
Hydrogel-basierte 3D-Zellkultursysteme bieten entscheidende Vorteile im Tissue Engineering für zellbasierte Therapie von Bandscheibendegeneration. Eine lichtmikroskopische Kontrolle sowohl der Kulturqualität als auch der morphologischen Differenzierung ist jedoch innerhalb dieser dichten Matrix nicht möglich. Für eine Beurteilung der Qualität müssen alternative Parameter berücksichtigt werden. In der vorliegenden Studie wurde die Verfügbarkeit von Sauerstoff im Kulturmedium und die Kinetik des pH-Wertes unter Verwendung des SDR analysiert. Beide Parameter sind Schlüsselfaktoren für eine erfolgreiche und zuverlässige in vitro Kultivierung und Differenzierung.
Wachstumskontrolle in 3D-Kultur
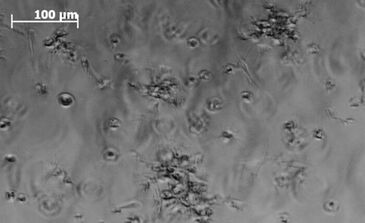
Die autologe Chondrozytentransplantation ist eine moderne experimentelle Therapie zur Behandlung degenerativer Bandscheibenerkrankungen. Auch eine Reparatur von Bandscheibenschädigungen durch transplantierte Chondrozyten scheint in naher Zukunft möglich. Man muss jedoch berücksichtigen, dass unter in vivo Bedingungen die Sauerstoffkonzentration innerhalb des Bandscheibenkerns sehr niedrig ist. Da Chondrozyten an diese Situation gewöhnt sind, könnte der Transfer in eine normoxische Kulturumgebung schädlich sein. Sensible Prozesse der in vitro Zellproliferation und -differenzierung können routinemäßig nur durch strikte Einhaltung definierter Kulturparameter erreicht werden. Chondrozyten wachsen in einer Gelmatrix besser als in Monolayerkultur, weil die räumliche Umgebung der Situation innerhalb der Bandscheibe besser ähnelt (Abb. 1). Genaue Messungen des Sauerstoffverbrauchs während der Kultivierung erlauben Rückschlüsse auf den physiologischen Status und die Qualität der Kulturbedingungen. Beide Kulturparameter konnten bisher nicht kontinuierlich überwacht werden - hauptsächlich, weil die erforderliche miniaturisierte Technik fehlte. Das optosensorische Messsystem SDR von PreSens ermöglicht nun die nicht-invasive Detektion beider Kulturparameter nahe der Zellen.
Nicht-invasive Online-Detektion
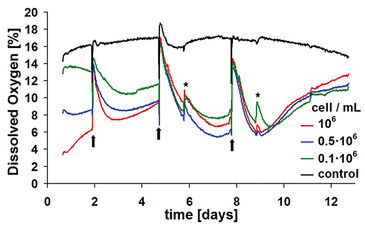
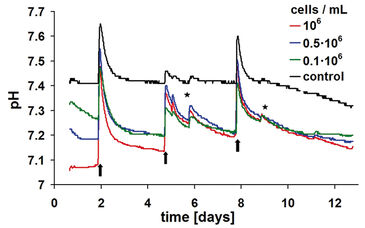
Die Charakterisierung der Kinetik von gelöstem Sauerstoff und pH-Wert wurde mit einer gut etablierten 3D-Kulturmethode durchgeführt. Drei definierte Zelldichten von 0,1, 0,5 und 1 · 106 Zellen/ml wurden auf einer proprietären Hydrogelmatrix für etwa zwei Wochen in OxoDishes® bzw. HydroDishes® kultiviert. Jede Vertiefung enthielt 2 ml gepuffertes Kulturmedium mit pH 7,4. Während der Studie wurde das Medium dreimal - an den Tagen 2, 5 und 8 - in den Proben mit Zellen sowie in den Kontrollen gewechselt. Das Online-Monitoring begann kurz nach dem Aussäen der Zellen. Optische Kontrollen wurden an den Tagen 6 und 9 durchgeführt. Zu diesem Zweck wurden die Multiplatten kurz aus der Standard-Inkubatoratmosphäre von 5 % CO2 / 95 % relativer Feuchtigkeit entfernt. Sauerstoffkinetiken wurden erstellt, indem der Durchschnitt von drei Replikaten pro Zelldichte berechnet wurde. Zellfreie Kulturen dienten als Kontrolle.
Überwachung von Sauerstoff- und pH-Kinetik
Proben mit höchster Dichte zeigten den höchsten Sauerstoffverbrauch und damit den niedrigsten Gehalt an gelöstem Sauerstoff (DO) im Kulturmedium (Abb. 2). Bei mittlerem Austausch stieg der DO wieder auf einen Wert, der ähnlich dem Ausgangsniveau von 14 bis 16 % Sauerstoff war, entsprechend der vorhergehenden Äquilibrierung des Mediums. Je nach Stoffwechselaktivität der Probe sank der Sauerstoffgehalt innerhalb kurzer Zeit wieder auf ein neues Minimum. Nach Erreichen eines Minimalpunktes nahm das Niveau an gelöstem Sauerstoff in allen Proben wieder zu. Der Grund dafür ist vermutlich eine starke Reduktion der Stoffwechselaktivität, da Chondrozyten den Crabtree-Effekt nutzen. Die Sauerstoffkinetik wurde durch weitere komplexe Faktoren bestimmt: Ein Faktor, der diesem Effekt Rechnung trägt, ist die Zellproliferation. Innerhalb der Probe mit 0,5 x 106 Zellen/ml war bereits nach dem zweiten Mediumwechsel eine ausgeprägtere Abnahme der Sauerstoffkinetik im Vergleich zur höchsten initialen Zelldichte zu erkennen, was auf eine höhere metabolische Aktivität hinwies. Ein weiterer Anstieg der Zelldichten führte daher zu einer verringerten Stoffwechselaktivität. Wie die Sauerstoffmessungen zeigten auch die pH-Kinetik eine charakteristische Dynamik entsprechend der Kultivierungsdauer und der initialen Zelldichte (Abb. 3). Die Kontrollen zeigten neben Veränderungen des Kulturmediums und Effekte durch Öffnen der Inkubatortür einen weitgehend stabilen pH-Wert. Die pH-Werte der Proben mit Zellen sanken schon früher ab, ohne jedoch Werte von pH 7,0 zu unterschreiten (vgl. oben Crabtree-Effekt). Bei den höheren Anfangszelldichten von 1,0 × 106 und 0,5 × 106 Zellen/ml dauert es nur etwa einen Tag, um das jeweilige pH-Minimum zu erreichen. Durch den Wechsel des Kulturmediums fand sowohl in Proben mit Zellen als auch in den zellfreien Kontrollen eine kurze pH-Verschiebung über den physiologisch optimalen Ausgangs-pH-Wert hinaus statt. Medien, die nicht in CO2-Atmosphäre vorinkubiert worden waren, zeigten als Folge erhöhte pH-Werte, bis sie wieder mit der Inkubatoratmosphäre äquilibriert waren. Diese Äquilibrierung konnte bis zu einem Tag dauern, da der Gasaustausch nur über passive Diffusion stattfand. Ein ähnlicher Effekt wurde auch beim Öffnen der Inkubatortür festgestellt: Bereits bei kurzem Öffnen trat CO2 nahezu vollständig aus der Inkubatoratmosphäre aus. Folglich erhöhte sich der pH-Wert des Kulturmediums. Die überlagernden Effekte des steilen pH-Anstiegs und -Abfalls nach dem Kulturmediemwechsel und der metabolisch bedingte Abwärtstrend behinderten eine genaue Interpretation der beobachteten pH-Kinetik. In Analogie zur Sauerstoffmessung deutete ein weniger ausgeprägter Abwärtstrend auf einen durch Substratmangel reduzierten Stoffwechsel hin. Durch kontinuierlichen pH-Nachweis konnte jedoch vermieden werden, dass der pH-Wert aufgrund einer gesteigerten metabolischen Aktivität auf ungünstig niedrige Werte absank. Letzteres hätte die zelluläre Aktivität hemmen oder sogar Zellschäden verursachen können. Die Online-Überwachung des pH-Werts lieferte somit wertvolle Hinweise, wann ein Kulturmedienwechsel nötig war.
Zellkulturkontrolle
Die nicht-invasive Überwachung von DO und pH mit dem SDR eignet sich gut für In-Process-Bewertungen der Kulturqualität und zur Bestimmung des optimalen Zeitpunkts für den Medienwechsel in 3D-Zellkulturen. Es ist wahrscheinlich, dass die Verwendung des hier beschriebenen Kultursystems die Qualität autologer Chondrozyten für die Transplantation verbessert. Durch DO-Kinetik können Standardprotokolle für eine noch effizientere Kultivierung von Chondrozyten abgeleitet und der optimale Zeitpunkt für die Chondrozytenernte bestimmt werden. Darüber hinaus ermöglicht das SDR durch den Nachweis von verfügbarem Sauerstoff erstmals einen präzisen Einblick in 3D-Zellkulturen. Präzise Messungen und der Vorteil der kontinuierlichen Datenerfassung unterstreichen das hohe Potential und den Vorteil für zukünftige Anwendungen dieses Systems im Tissue Engineering. Neben der Überwachung der metabolischen Substratversauerung ist das pH-Messsystem auch ein außergewöhnliches Instrument zum Schutz und zur Kontrolle von Pufferparametern in einem bestimmten Kulturmedium. Mit einer solchen Instrumentierung können Unternehmen die Qualität von Zell- und Tissueprodukten verbessern und ihren therapeutischen Nutzen für Patienten schneller erzielen.
Applikationsbericht nach
BioProcess International, 12/2008, 54 - 59.