Tutorials, Webinare und informative Videos über unsere optischen Sensorsysteme
Überwachung des räumlich-zeitlichen Sauerstoffverbrauchs in lebenden 3D-Krebs-Sphäroiden
VisiSens TD mit MIC Kit ermöglicht neue Einblicke
Carina Schmittlein1, Robert Johannes Meier2, Christina Hupf1, Joachim Wegener1,3
1Institut für Analytische Chemie, Chemo- und Biosensorik, Universität Regensburg, Regensburg, Deutschland
2PreSens Precision Sensing GmbH, Regensburg, Deutschland
3Fraunhofer-Einrichtung für Mikrosysteme und Festkörper-Technologien (EMFT), Regensburg, Deutschland
Lokale Sauerstoffgradienten sind in allen Geweben vorhanden, sei es natürlich oder künstlich. Die Sauerstoffversorgung des Gewebes beeinflusst die Migration, Proliferation und Differenzierung von Zellen. Hypoxische Umgebungen sind für bestimmte Entwicklungsprozesse notwendig, z. B. benötigen embryonale und adulte Stammzellen eine bestimmte Sauerstoffspannung, um ihre Pluripotenz zu erhalten, sich zu differenzieren oder ihre Differenzierung zu erhalten. Hypoxische Mikroumgebungen sind jedoch auch ein typisches Merkmal für Krebsgewebe, da der Stoffwechsel dort hochreguliert ist. Multizelluläre Tumorspheroide (MCTS) gelten als nützliche in vitro Alternative zur Arbeit mit in vivo oder ex vivo Tumormaterial. Sie sind ein leistungsfähiges Instrument zur Untersuchung der Auswirkungen von Krebsmedikamenten, da sie eine Zwischenstufe zwischen 2D-Monolayer-Zellen und regulären Gewebestrukturen darstellen. Für die Tumorforschung ist das Wissen über den Sauerstoffgehalt in Sphäroiden und ihren verschiedenen Zonen (Proliferationszone, Ruhezone, nekrotische Zone) von großem Interesse. Die mangelnde Sauerstoffversorgung in zentralen Sphäroidregionen kann zu ruhenden oder nekrotischen Kernen führen. Der Oxygenierungsstatus kann als ein Indikator für die Wirksamkeit von Krebsmedikamenten dienen und dabei helfen, geeignete und personalisierte Medikamente zu identifizieren und auszuwählen. Für Informationen über zeitlich und räumlich aufgelöste Oxygenierung und Hypoxie in lebenden 3D-Zellkulturen gibt es noch keine geeigneten und biokompatiblen Messverfahren. Hier stellen wir eine Technik vor, die eine räumlich und zeitlich aufgelöste Überwachung in 3D-Zellkulturmodellen unter Wachstumsbedingungen über längere Zeiträume hinweg ermöglicht. Sie erlaubt automatisierte, nicht-invasive Messungen innerhalb eines normalen Inkubationssystems und liefert 2D-Querschnittsbilder der Sauerstoffprofile.
Material & Methoden
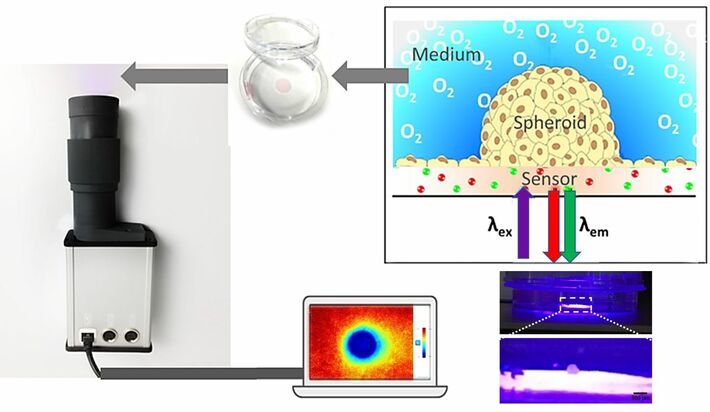
Räumlich-zeitliche Gradienten wurden mit dem 2D-Sauerstoff-Bildgebungssystem VisiSens TD (PreSens, Regensburg, Deutschland) mit einem speziellen mikroskopischen Imagingaufsatz, bestehend aus einem Mikroskopobjektiv und einer angepassten Anregungslichtquelle (VisiSens TD MIC Kit), aufgenommen. Um die lokalen Sauerstoffkonzentration zu quantifizieren wurden SF-RPSu4 Sauerstoffsensorfolien (PreSens, Regensburg, Deutschland) verwendet. Die Aufnahme von 2D-Einzelbildern oder Zeitreihenbildern sowie die Bildauswertung erfolgte mit der VisiSens ScientifiCal Software. Die Sensoren wurden mittels einer Zweipunktkalibrierung mit 0 % und 100 % luftgesättigten Medien bei 37 °C kalibriert.
Stücke der O2-Sensorfolie (Wachstumsfläche von 0,385 cm²) wurden mit Silikonkleber (Typ SG-1) auf den Boden einer Standard-Petrischale mit 3,5 cm Durchmesser geklebt. Die weiße optische Isolierschicht wurde von den Sensorfolien abgezogen. Petrischalen mit integrierten Sensoren wurden 1 Minute lang mit Argonplasma behandelt. Dann wurde die sauerstoffempfindliche Folie mit 150 µl fötalem Kälberserum (FCS) beschichtet, um die Zelladhäsion zu unterstützen. Eine runde PDMS-Kammer mit einem Durchmesser von 0,7 cm wurde um die Sensorfolie gelegt, um die Aussaat der Sphäroide zu vereinfachen und sie während der Anheftungsphase an ihrem Platz zu halten. 100 µl MCF-7-Medium mit einem einzelnen 3D kultivierten Sphäroid (Ausgangszellzahl 3000; ca. 500 µm Durchmesser) wurden auf die Sauerstoffsensorfolie gegeben. Der umgebende Bereich der Petrischale wurde mit MCF-7-Medium gefüllt, um zu verhindern, dass die Proben trocken fallen. Die Sphäroide wurden 24 Stunden lang auf der Oberfläche der sauerstoffempfindlichen Substrate anhaften gelassen (37° C, 5 % CO2).
Ergebnisse
Nach der Aussaat setzt sich das Sphäroid auf der Sensorfolie ab, haftet an und bildet eine halb-sphäroide Struktur auf der 2D-Sensorfolie. Die halbkugelförmige Form und die Anheftung an die Sensorfolie werden durch konfokale Laser-Scanning-Mikroskopie nach CaAM-Färbung bestätigt (siehe Abbildung 2A). Die limitierte Permeabilität und Transparenz des 3D-Gewebes verhindert die Diffusion des Färbemittels und das Eindringen des Anregungslichts in tiefere Teile des Sphäroids. Dadurch zeigt CaAM eine hellgrüne Fluoreszenz in lebenden Zellen der äußeren Sphäroidregion mit einer schwarzen Region im Inneren des Sphäroids. Einige Zellen aus dem ursprünglichen Sphäroid wachsen aus und breiten sich um die Hemisphäre herum aus. Die rote Lumineszenz wird von der Sensorfolie erzeugt. Die halbkugelförmige Struktur, die an der planaren Sauerstoffsensorfolie angeheftet ist, ermöglicht es, direkte 2D-Sauerstoffkarten in der Kontaktzone zwischen Sphäroid und Sensorfolie aufzunehmen und jegliche Gradienten im Inneren zu visualisieren. Das Imagingsystem wurde auf die Sensorfolie mit dem aufgeklebten Sphäroid fokussiert. Die Bilder wurden automatisch alle 15 Minuten über einen Zeitraum von 12 Stunden aufgenommen, um die Möglichkeit einer Langzeitbeobachtung des Sphäroids im Querschnitt zu zeigen.
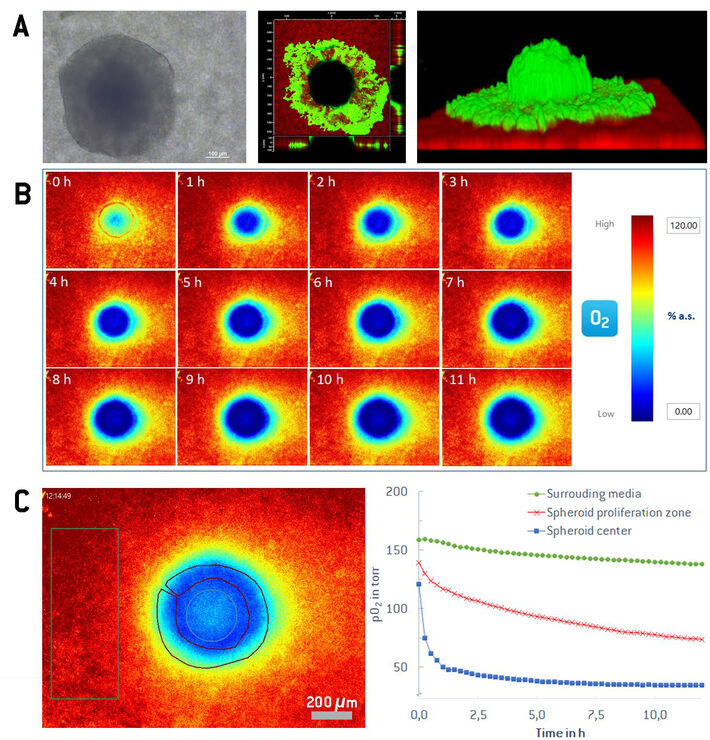
Abbildung 2B zeigt beispielhafte 2D-Sauerstoffkarten in Pseudofarbe eines Querschnitts eines MCF-7-Sphäroids über eine 12-Stunden-Zeitreihe unter Wachstumsbedingungen. Um 0 Uhr wurde frisches Medium in die Petrischale gegeben, was zu einer erneuten Sauerstoffzufuhr führte. Der innere Kern des Sphäroids wird innerhalb der ersten zwei Stunden schnell wieder hypoxisch, was mit bloßem Auge an den violetten und blauen Farben der Pseudofarbskala deutlich erkennbar ist. Der Sauerstoffgradient durch die Sphäroidregionen wird auch in der 2D-Sauerstoffkarte deutlich sichtbar. Neben der visuellen Pseudo-Farbdarstellung erlaubt das VisiSens-Auswertungsprogramm die freie Auswahl von Regions of Interest (ROIs) für die verschiedenen Bereiche in einem Sauerstoffbild, und liefert Mittelwerte mit Statistiken in den ausgewählten Bereichen. Die Sauerstoffkonzentration reicht vom vollständig sauerstoffangereicherten Medium (pO2 von 150-160 Torr), das das Sphäroid umgibt, über den steilen Gradienten durch die Proliferationszone (100 bis 50 Torr) bis hin zu einer hypoxischen Ruhezone im Zentrum des Sphäroids (bis zu 20 Torr). Eine weitere Stärke der Bild-basierten Sauerstoffkartierung besteht darin, dass die verschiedenen ROIs über die Zeit untersucht werden können, was zu Erkenntnissen über die zeitlichen Veränderungen während des Experiments führt. Abbildung 2C zeigt einen Vergleich des Mediums, der Proliferationszone und des hypoxischen Sphäroidkerns über einen Zeitraum von 12 Stunden.
Diskussion & Fazit
Die chemische Analyse von Sphäroiden mit herkömmlichen Färbemethoden, wie z. B. mit Indikatorfarbstoffen oder Nanopartikelsensoren, verursachen mehrere schwerwiegende Probleme. Erstens müssen die Färbemittel oder Partikelsonden alle vorgesehenen Bereiche erreichen, was durch Diffusionsbeschränkungen innerhalb des Sphäroids behindert wird, so dass nur die Peripherie des 3D-Sphäroids gefärbt wird und beurteilt werden kann. Die begrenzte Färbung von 3D-Gewebsmodellen geht mit der begrenzten Eindringtiefe von sichtbarem Licht in Gewebe einher, so dass die inneren Teile der Sphäroide nicht erreicht werden, insbesondere bei größeren Sphäroiden (>250 µm). Darüber hinaus haben Indikatoren für molekularem Sauerstoff hohe Photobleichungsraten und schwere Phototoxizität durch die Bildung von Singulett-Sauerstoff , was eine zeitlich aufgelöste Sauerstoffüberwachung unmöglich macht. Zudem verändert die Aggregation der Farbstoffe selbst oder in bestimmten Nischen die aufgezeichneten Signale unabhängig vom Sauerstoffstatus und führt so zu fehlerhaften Ergebnissen und erschwert die Quantifizierung. Sensor-Nanopartikel liefern normalerweise eine abgeschirmte Mikroumgebung und reduzieren die Freisetzung von Singulett-Sauerstoff bis zu einem gewissen Grad, aber sie verändern die innere Sphäroidstruktur und -integrität. Die strukturellen Störungen können den Sauerstoff- und Nährstofftransport innerhalb des Sphäroids verändern, indem sie der Masse gasdurchlässige und nährstoffundurchlässige Materialien hinzufügen.
Die Sensorfolien- und Imaging-basierte Methode überwindet diese Nachteile und ermöglicht die direkte Darstellung von zeitlichen und räumlichen Veränderungen der Sauerstoffversorgung in einem Querschnitt durch das Sphäroid. Die Verwendung planarer Sensorfolien und des VisiSens TD-Systems mit MIC-Konfiguration ermöglicht darüber hinaus eine Langzeitüberwachung während der Sphäroidkultur unter Wachstumsbedingungen. Dies ermöglicht die Durchführung von Studien im Bereich Tissue Engineering, Medikamententests, Screening oder Krebsforschung.


